【Merck】神经球培养方案
中枢神经系统的脑癌包括神经母细胞瘤、神经胶质瘤、脑膜瘤和垂体腺瘤。最具侵袭性的脑肿瘤之一是作为U-87 MG胶质母细胞瘤细胞系(89081402)来源的多形性胶质母细胞瘤。三维神经球细胞培养技术最早由Reynolds和Weiss (1992)描述,包括在称为神经球的自由漂浮球形簇中培养神经干细胞。来自脑源性肿瘤的神经球被认为是由肿瘤内的肿瘤干细胞(CSC)亚群在3D环境中生长而来的。这些肿瘤干细胞群表达干细胞相关标记物Nestin和Sox2,而缺乏GFAP。脑源性肿瘤细胞的3D培养被认为是一种更具有生物学意义的细胞培养模型,可维持原发恶性肿瘤表型。
在胎牛血清(FBS)中培养的脑癌细胞发生了不需要的表型改变和细胞分化,而在无血清条件下培养的3D神经球则保持了原发肿瘤的原始性质。然而,传统的培养神经球的无血清培养基难以有效地维持肿瘤干细胞(CSC)的自我更新亚群。因此,随着细胞增殖速度的增加,干细胞的数量逐渐减少。PromoCell 3D Tumorsphere Media XF (C-28070,C-28075)被设计用于连续传代脑肿瘤衍生细胞系,使其成为具有高细胞增殖率的未分化3D神经球。它的明确无血清配方允许一致和标准化的神经球扩张,同时保持肿瘤干细胞的特性,如自我更新和化疗耐药性。
试剂耗材准备
货号 | 说明 |
C-28070 | 3D Tumorsphere media XF |
C-28075 | 3D Tumorsphere media XF |
D8537 | DPBS |
T3924 | 胰蛋白酶-EDTA 溶液 |
T6414 | 胰蛋白酶中和溶液 |
实验步骤
1. 采集粘附细胞。采集神经细胞作为单细胞悬浮液,重悬在3-5 mL新鲜3D Tumorsphere Media XF培养基中(C-28070, C-28075)。
2. 计算细胞数。计算活细胞数,在300 x g的浓度下旋转5分钟。浓度达到1X106 cells/ml。
3. 接种细胞。将细胞接种于合适的悬浮培养容器(Corning ULA或Spheroid Plates),6孔板每孔内浓度达到1X104细胞/ml(即4 ml 内4X104 细胞)。
4. 细胞生长。孵育4-10天。每3-4天用新鲜的3D Tumorsphere media XF (C-28070, C-28075)培养基刷新一半培养基。
5. 传代神经球。在神经球形成黑色坏死中心前传代神经球。将所有的神经球转移到15 ml的锥形管中。让神经球在室温下凭重力沉降10-15分钟。
6. 清洗球体。去除上清液,按照以上步骤#5用PBS (D8537)洗涤2遍。
7. 酶解神经球。抽取PBS,重悬于1 ml胰蛋白酶-EDTA (T3924)中,室温下孵育2-4分钟。每30秒用移液器移动一次。不要 让神经球沉淀。
8.分解神经球。用P1000移液10-20次,将神经球分解为更小的聚合体。添加两次胰蛋白酶中和液(T6414)。
9. 计算细胞数。计算活细胞数,在300g的浓度下旋转5分钟。以1百万细胞/ml的浓度重悬在新鲜3D Tumorsphere Media XF培养基中(C-28070, C-28075)。
10.接种细胞。使用低附着板在6孔板每孔内接种1X104细胞/ml(即4ml 培养基内4X104细胞)。
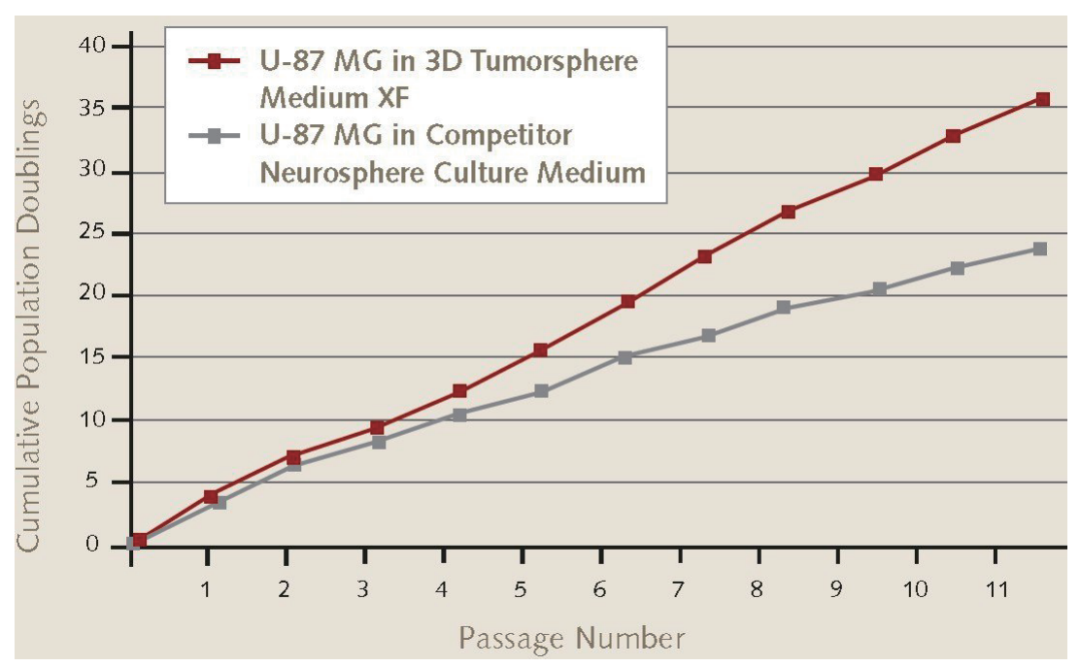
图1.U-87 MG胶质母细胞瘤细胞在3D神经球培养基中的增殖率。U-87 MG胶质母细胞瘤细胞(89081402)在Promocell公司的3D Tumosphere Media XF中传代11次后,其神经球增殖率高于其他竞争性神经球培养基。
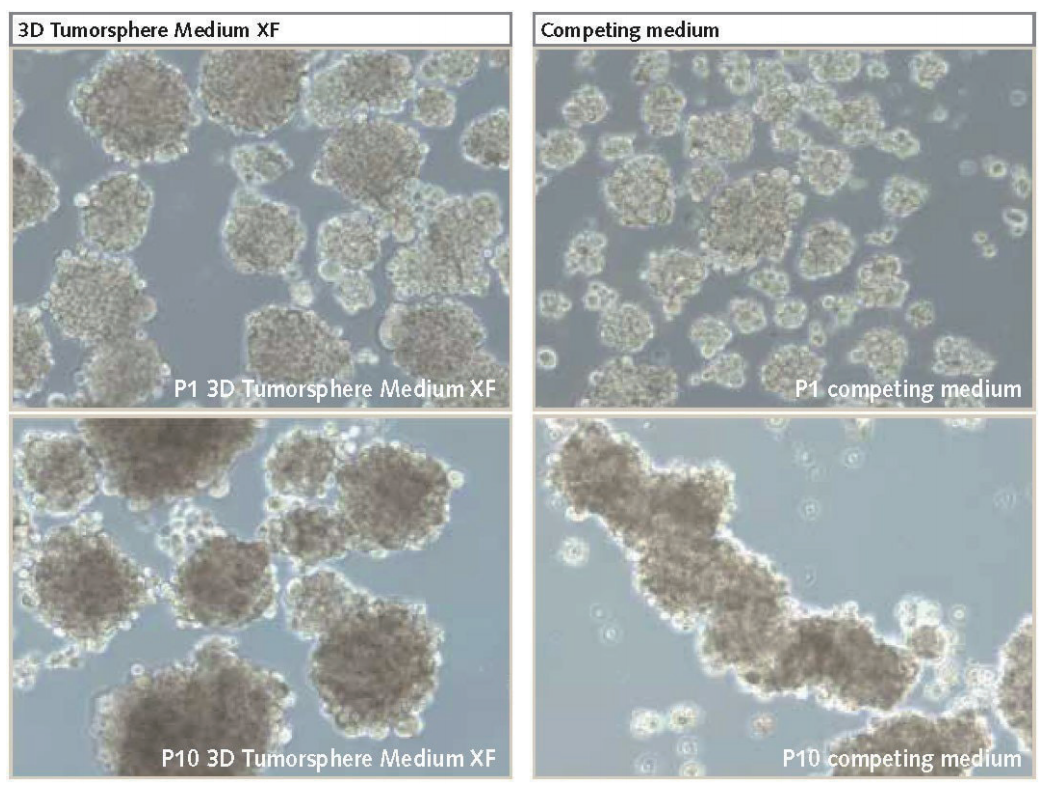
图2.U-87 MG细胞培养为3D神经球。与竞争产品(放大倍数为100)相比,在PromoCell的3D Tumorsphere Media XF中培养的神经球增殖率更高,且在多次传代后(P10)体积更大。
参考文献
1. Lee J, Kotliarova S, Kotliarov Y, Li A, Su Q, Donin NM, Pastorino S, Purow BW, Christopher N, Zhang W, et al. 2006. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9(5):391-403. http://dx.doi.org/10.1016/j.ccr.2006.03.030
2. McLendon RE, Rich JN. 2011. Glioblastoma Stem Cells: A Neuropathologist's View. Journal of Oncology. 20111-8. http://dx.-doi.org/10.1155/2011/397195
3. Lawson HC, Sampath P, Bohan E, Park MC, Hussain N, Olivi A, Weingart J, Kleinberg L, Brem H. 2007. Interstitial chemotherapy for malignant gliomas: the Johns Hopkins experience. J Neurooncol. 83(1):61-70. http://dx.doi.org/10.1007/s11060-006-9303-1
4. Vescovi AL, Galli R, Reynolds BA. 2006. Brain tumour stem cells. Nat Rev Cancer. 6(6):425-436. http://dx.doi.org/10.1038/nrc1889
5. Schiffer D, Mellai M, Annovazzi L, Piazzi A, Monzeglio O, Caldera V. 2012. Glioblastoma cancer stem cells: Basis for a functional hypothesis. SCD. 02(03):122-131. http://dx.doi.org/10.4236/scd.2012.23017
6. Gürsel DB, Shin BJ, Burkhardt J, Kesavabhotla K, Schlaff CD, Boockvar JA. Glioblastoma Stem-Like Cells?Biology and Therapeutic Implications. Cancers. 3(2):2655-2666. http://dx.doi.org/10.3390/cancers3022655
7. Yuan X, Curtin J, Xiong Y, Liu G, Waschsmann-Hogiu S, Farkas DL, Black KL, Yu JS. 2004. Isolation of cancer stem cells from adult glioblastoma multiforme. Oncogene. 23(58):9392-9400. http://dx.doi.org/10.1038/sj.onc.1208311
8. Günther HS, Schmidt NO, Phillips HS, Kemming D, Kharbanda S, Soriano R, Modrusan Z, Meissner H, Westphal M, Lamszus K. 2008.
Glioblastoma-derived stem cell-enriched cultures form distinct subgroups according to molecular and phenotypic criteria. Oncogene. 27(20):2897-2909. http://dx.doi.org/10.1038/sj.onc.1210949
9. Reynolds B, Weiss S. 1992. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255(5052):1707-1710. http://dx.doi.org/10.1126/science.1553558
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味