【Merck】染色质免疫沉淀(ChIP)常见问题及解决方案
染色体免疫沉淀(ChIP)是用于研究细胞内蛋白在染色体DNA上分布的经典技术。这些蛋白质可能是组蛋白亚单位、转录因子或与DNA直接或间接结合的其它调节蛋白或结构蛋白。
对于成功的ChIP实验,选择适当的ChIP抗体是最关键的步骤之一。即使是最高质量的抗体,即在经典的Western blot验证中表现非常好的抗体,也不一定适合ChIP。最好只考虑使用在ChIP实验中专门验证过的抗体。
一般的,ChIP实验之后会用定量PCR (gPCR)来验证某一特定DNA序列是否与靶蛋白有关。研究人员可以采用这种经典方法评估目标蛋白与已知的靶基因之间的相互作用。
ChIP实验可以细分为以下几个主要步骤:
●样品制备
●蛋白与DNA交联
●细胞裂解和染色质片段化
●染色质免疫沉淀
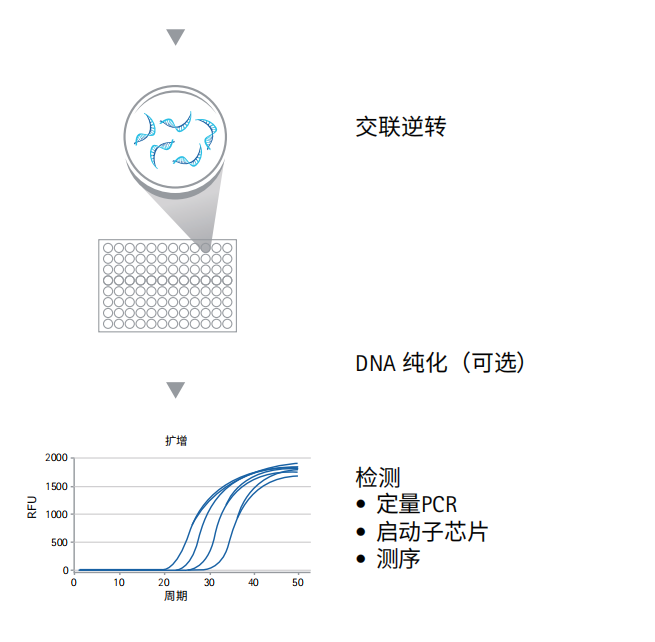
●洗涤、洗脱和交联逆转
●DNA纯化
●PCR分析

Troubleshooting
问题1:在阴性对照 (IgG或mock IP) 样品中本底较高 | |
可能原因 | 解决方案 |
抗体过量导致抗体与非靶蛋白结合 | 优化抗体的浓度。 |
与珠子的非特异性结合 | 加入一个预清除步骤,以排除这些非特异性蛋白或添加珠子的阻断剂。 |
染色质的不完全裂解 | 优化裂解过程,以获得介于200-1000bp长度的染色质。对每种细胞类型或组织类型单独优化裂解。使用硅化试管或低吸附试管。 |
试剂污染 | 确保所有试剂都是新鲜配制的,且没有污染物。增加洗涤次数。 运行一次“无DNA”PCR反应,以确定您的样品是否被核酸污染。 |
问题2:“无DNA” PCR反应显 示信号 | |
解决方案 | |
使用PCR的专用移液管;在设置PCR之前,使用紫外线照射移液管。 | |
采用专用移液管,在三个不同的房间/区域进行ChIP、DNA纯化和PCR反应设置,或在通风橱内设置反应。 | |
避免使用瓶装水或其它形式的预包装水。使用从含有紫外光源的Milli-Q®系统中制造的水。 | |
使用防雾移液管吸头。 | |
在将进行ChIP或qPCR实验的地点附近,不得打开含有扩增PCR产物的试管。 | |
问题3:DNA的较低回收率 | |
可能原因 | 解决方案 |
ChIP抗体无效或较低亲和力 | 确保您使用的抗体是在ChIP中验证过的抗体。关于ChIP抗体的完整选择过程,请参见www.emdmillipore.com/表观遗传学。如果您正使用ChIP抗体,请增加抗体的孵育时间。 |
ChIP抗体不足 | 一般1-10μg ChIP抗体是足够的。但是,所需抗体量可能取决于您的靶蛋白相对丰度和抗体与靶标的亲和力。 |
起始样品不足 | 在交联前,单独准备一个平板,用于测定细胞数。重新评价每个反应的细胞数。增加您的细胞数,特别是在尝试检测较低丰度的靶蛋白时。 |
细胞不完全溶解和无效裂解 | 通过改变参数和评估他们对染色质回收率的影响来优化这些步骤。使用机械力,如杜恩斯匀浆器或玻璃珠改善细胞溶解。优化裂解步骤和避免起泡。 |
交联过度 | 在甲醛中培养时间过长可能掩盖经ChIP抗体识别所需要的表位。如果您使用的是单克隆抗体,此问题可能更加严重。过度交联也可能导致超声处理时复合物难以形成。优化交联步骤:甲醛的最终浓度应为1%;您应确定最有效的交联时间,然后再继续进行实验。 |
交联不足 | 在研究方案的后续步骤中,交联不足可能引起靶蛋白从DNA解离。除 非您正在研究组蛋白和组蛋白修饰,否则您应采用X-ChIP方案,以使您的靶蛋白与DNA的连接稳定。增加交联时间。 |
亲和力较低或珠子质量较差 | 蛋白G磁珠能结合更大范围的抗体,包括小鼠单克隆抗体。为达到抗体选择的最大灵活性,我们推荐使用蛋白A/G混合物(目录号16-663)。 |
PCR引物 | 检测PCR引物的效果。加入相应的对照物,必要时重新设计引物。 |
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味