【Cytiva】WB实验流程之定量蛋白质免疫印迹
使用胶片、激光扫描成像仪或CCD成像仪检测膜时,会在获取的图像上观察到一个或多个可见的蛋白质条带。蛋白质的分子量可以通过条带与Marker的相对位置来计算,用条带的灰度计算蛋白质的表达量(检测限范围内)。在多种应用中,可以利用蛋白质条带确认蛋白质的存在(定性)并粗略计算表达量。许多应用需要定量分析,以相对或绝对定量的方式计算蛋白质表达水平。本章的目的是为蛋白质印迹分析以及如何在蛋白质印迹实验中实现精确定量提供指导。
定量蛋白质免疫印迹
长期以来,蛋白质的定性分析一直采用western来确认蛋白质的存在,并大致估计蛋白质的含量。然而,随着高灵敏度检测试剂的发展,加上先进的成像技术,蛋白质印迹技术已成为蛋白质定量分析的潜在工具。定量蛋白质印迹时,应考虑一些重要因素:
• 灵敏度 Sensitivity
• 线性范围 Linear dynamic range
• 信号稳定性 Signal stability
• 归一化 Normalization
• 信噪比 Signal-to-noise ratio
灵敏度 Sensitivity
灵敏度,为可用检测系统检测到的最小蛋白质量(见第6章)。灵敏度受多种因素影响,如抗体质量、抗体浓度、检测方法和曝光时间。
通常使用两个术语来定义分析灵敏度;检测限(LOD)是在给定的分析中可以“看到”的最小蛋白质量。通常,我们将可靠地精确定量的最低浓度,命名为定量限(LOQ)。定量限由信噪比确定。
线性范围 Linear dynamic range
线性动态范围是指信号强度与印迹上的蛋白质量成比例的范围,从而允许在整个范围内进行精确定量。过多的蛋白质或高浓度抗体,但也过多的曝光时间,可能导致信号饱和,而不再与蛋白质浓度成正比,因此必须将此情况排除在分析之外(图1)。线性动态范围也会受到检测限的影响:低LOD(即高灵敏度)的检测系统,可以同时对强和弱信号精确定量,提供较宽的线性动态范围。

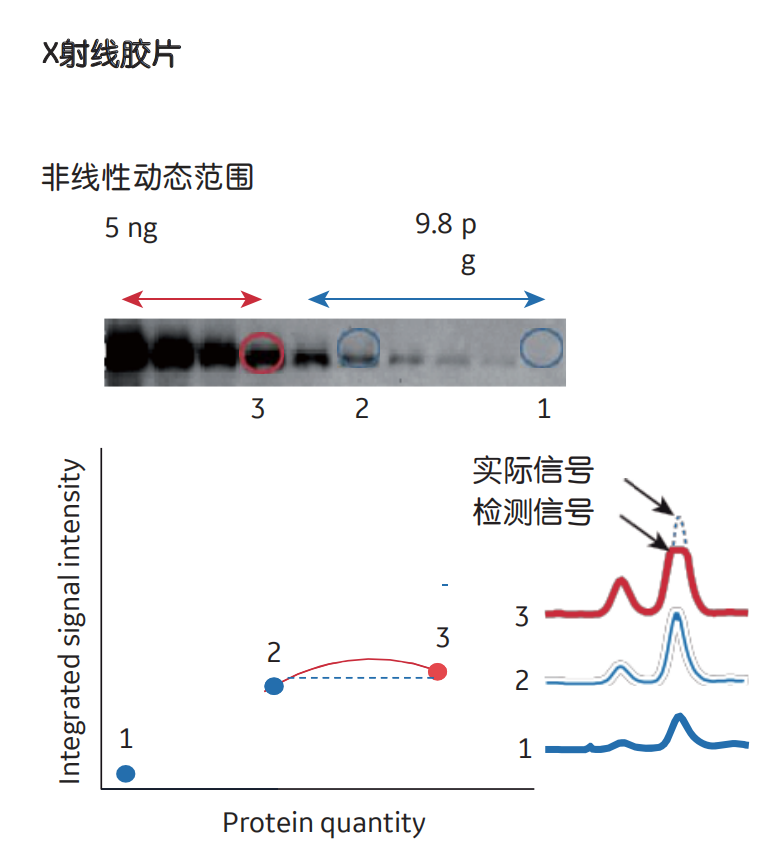
图1 与X射线胶片相比,使用CCD拍照式成像仪进行信号检测的优势。对于CCD拍照式系统,所有条带都在系统的线性动态范围内,而对于胶片,高丰度的条带(表明表达更多蛋白质)是饱和的,无法准确获取条带峰面积,所以不能定量。
对于化学发光检测,胶片具有很高的灵敏度,但动态范围有限。为了使用胶片获得最佳灵敏度,需要增加曝光时间,但这会导致高丰度蛋白质的信号饱和,从而导致更窄的线性动态范围。
CCD拍照式成像仪除了可以提高灵敏度外,还可以实现在更宽的线性动态范围内进行定量。但是,如果只想粗略观察表达量的变化趋势,或者定性检测(判断样品中是否存在蛋白质)就可以满足要求,胶片也是一种好方法。
对于荧光检测,基于发光二极管LED-CCD的成像仪和基于激光LD-PMT的扫描成像仪都可以获得高灵敏度和宽动态范围的图像。但是,基于激光LD-PMT的扫描成像仪通常比CCD成像仪的动态范围更宽。
信号稳定性 Signal Stability
定量Western blotting时,使用高稳定性的检测系统是一种优势,因为这将影响线性动态范围。在信号检测试剂稳定的情况下,达到高灵敏度的时间窗口期较长,这允许多次曝光,避免在一次短暂的曝光中错过的弱条带。
区分“稳定性stability”和“持续时间duration”这两个术语很重要。例如,化学发光检测系统是基于酶促反应,因此信号强度随着时间的推移而降低。这意味着荧光体系(如Amersham ECL Plex)所获得的信号稳定性(荧光信号随时间稳定且具有高度可重复性)是化学发光不能相比的。但是,有些ECL试剂可以延长信号的持续时间,如Amersham ECL Prime(图2),它可以实现多次曝光,而无信号快速降低的风险,这是定量蛋白质印迹应用的先决条件。
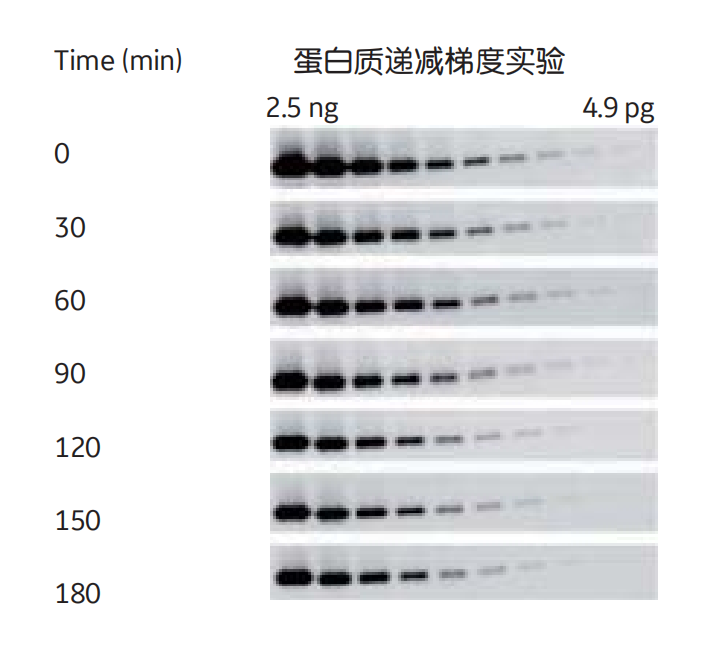
图2 为加入Amersham ECL Prime试剂的信号持续时间。在3小时内,每30分钟拍一张图像,每张图像曝光时长为3分钟。即使在3小时后,大部分条带仍然可以检测到,也可以进行精确的定量。
归一化 Normalizaion
为了通过蛋白质印迹分析目的蛋白的表达水平,必须用内参蛋白进行归一化才能可靠地定量。这种设计可以避免泳道间的上样偏差,如加样体积不同或加样的蛋白质浓度不同,导致不同泳道的总蛋白量不同。如果样品是细胞裂解液,则通常将内源性的、不受调节的“看家蛋白Housekeeping”(即相对稳定的表达量并维持基本细胞功能所需的蛋白质)当作参比(图3和图4)。另一种参比设计是将目的蛋白质与在印迹上这条泳道检测到的总蛋白质的表达量关联起来。
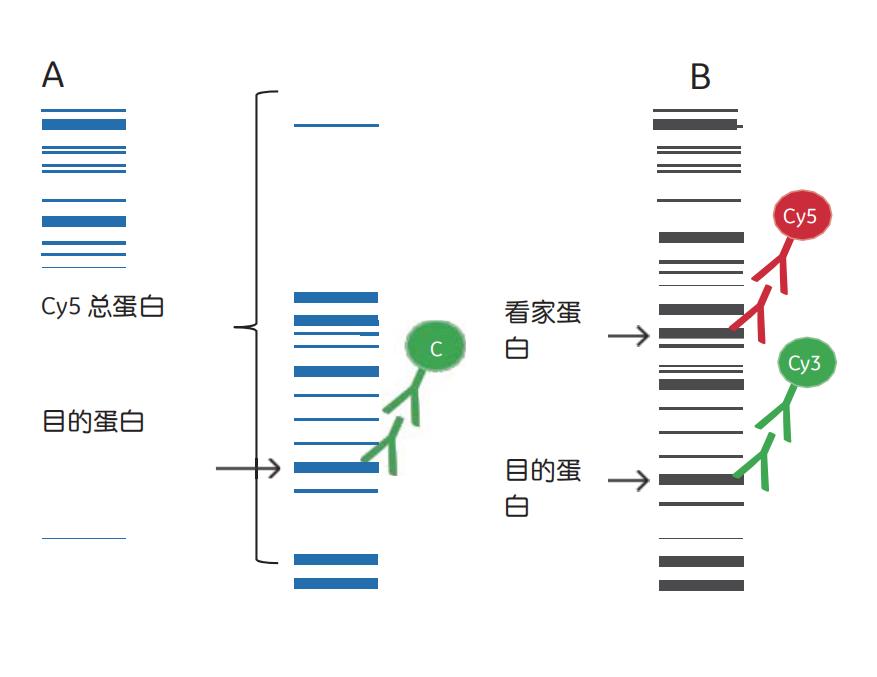
图3 为目标蛋白归一化的参比方式。使用荧光基团(Cy3)或ECL检测来检测目标信号。上样参比可以是通过cy5预标记、转移后膜蛋白染色(a)获得的总蛋白带的总和,或者是看家蛋白,如actin、tubulin、GAPDH(b)。首先,使用分析软件计算每个条带的灰度,将目标蛋白与参比的灰度值比值进行归一化。

图4 用cy5总蛋白荧光染色进行归一化。用cy5预标记不同浓度梯度的同一CHO细胞裂解液,并进行Western blotting。用抗ERK1/2一抗和Cy3标记的二抗(A)免疫印迹。目标蛋白cy3和参比cy5信号成正比(B),且cy3/cy5(C)的归一化比值虽然有很大变化,但是与同一样本的预估相似。
(ECL)检测方法允许您在一个实验中检测同一个印迹上的两种蛋白质,只要它们的分子量相差足够大,可以通过电泳分离即可(图8.5)。这种方法需要对一抗进行筛选,以排除交叉反应。在具有相似分子量或交叉反应性的情况下,需要洗膜Stripping和再标记Reprobing来检测看家蛋白和目标蛋白。然而,洗膜时会丢失未知量的靶蛋白,可能会导致的结果错误。
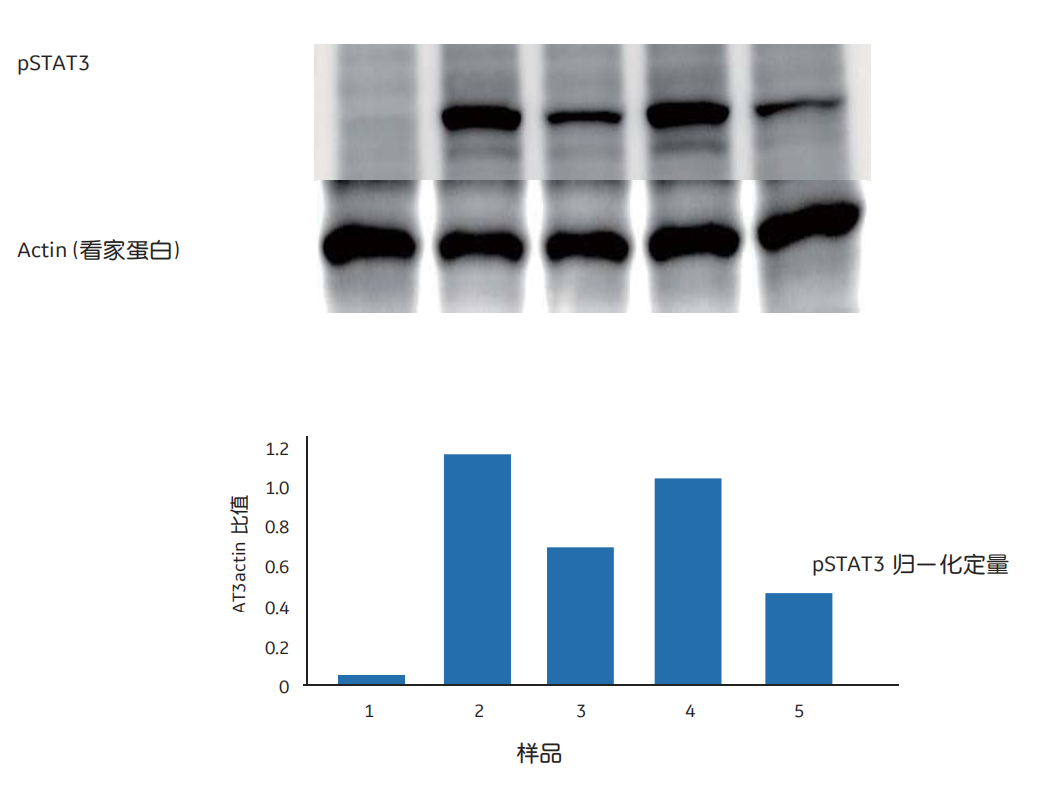
图5 Western blotting检测五个不同的Hela细胞裂解物中Tyr 705-phosphorylated STAT3 (pSTAT3)。在每一个泳道中,在肌动蛋白Actin作为看家蛋白归一化后定量测定pSTAT3水平。使用Amersham ECL Prime和ImageQuant LAS 4000 Mini(现已被Amersham Image 680系列CCD成像仪取代)进行检测,并使用ImageQuant TL软件进行分析。
利用Amersham ECL Plex,实现多重荧光蛋白印迹法,可以同时检测同一印迹上的两种靶蛋白,可以很容易进行归一化定量(图8.6)。该方法能够检测分子量非常相似甚至相同的蛋白质。此外,Amersham ECL Plex提供不同染料偶联的二抗,降低和避免交叉反应。
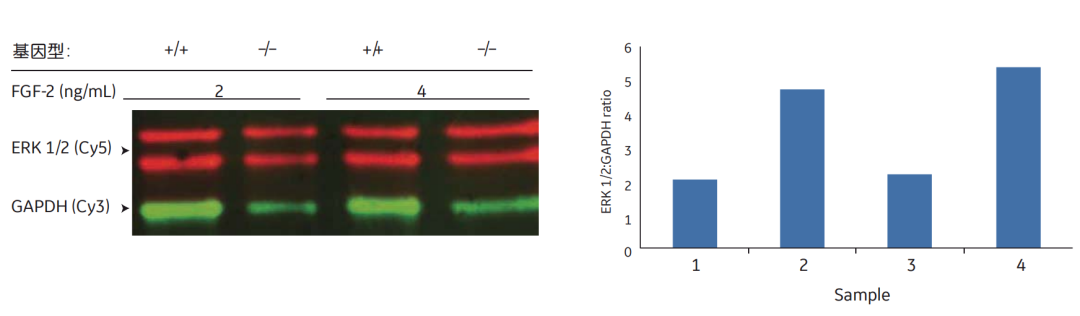
图6 在这种多重Western blot中,同时使用ERK1/2和看家蛋白GAPDH的一抗来免疫印迹膜,将结果归一化后,呈现凝胶中每一条泳道的蛋白质量,以定量的方式展示FGF-2的处理,对ERK1/2影响的真实效果。+/+表示野生型细胞,-/-表示敲除的细胞中缺乏一种可能参与调节ERK1/2的酶。Data courtesy of Dr. Jin-Ping Li and Dr. Juan Jia, Department of Medical Biochemistry and Microbiology, Uppsala University, Sweden.
信噪比 Signal-to-noise ratio
要正确地定量蛋白质,必须考虑特定的信号以及背景(由于不必要的相互作用而产生的信号)。背景包括与其他蛋白质结合的一抗,或者印迹膜和封闭液的类型,以及噪声(系统产生的信号)。
通常每个蛋白质条带对应一个信号峰,在该峰下但高于背景水平的峰面积,会与蛋白质的表达量成正比(图8.7)。
利用ECL-胶片分析是定量检测的敏感方法。即使如此,与CCD拍照式成像仪相比,胶片在低丰度的水平上的定量精
度,会被信号饱和度所抵消。换言之,胶片提供的线性动态范围明显小于CCD拍照式成像仪。此外,将弱信号放大到可检测水平,所需的曝光时间往往会导致高背景信号,从而掩盖目的蛋白质的信号。
背景和噪声使信噪比降低,从而影响蛋白质印迹的灵敏度和检出限。图8.8 高背景降低信噪比,并对线性产生不利影响,导致定量精度降低。
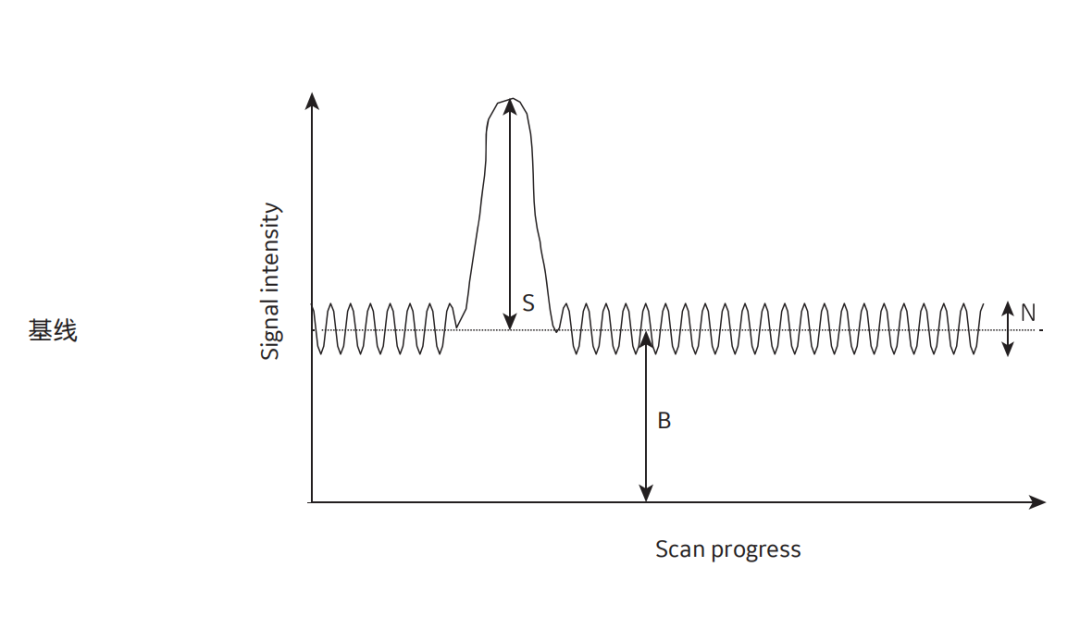
图7 信号检测的原理图。B = 背景background, N = 噪声noise, S =信号 signal.
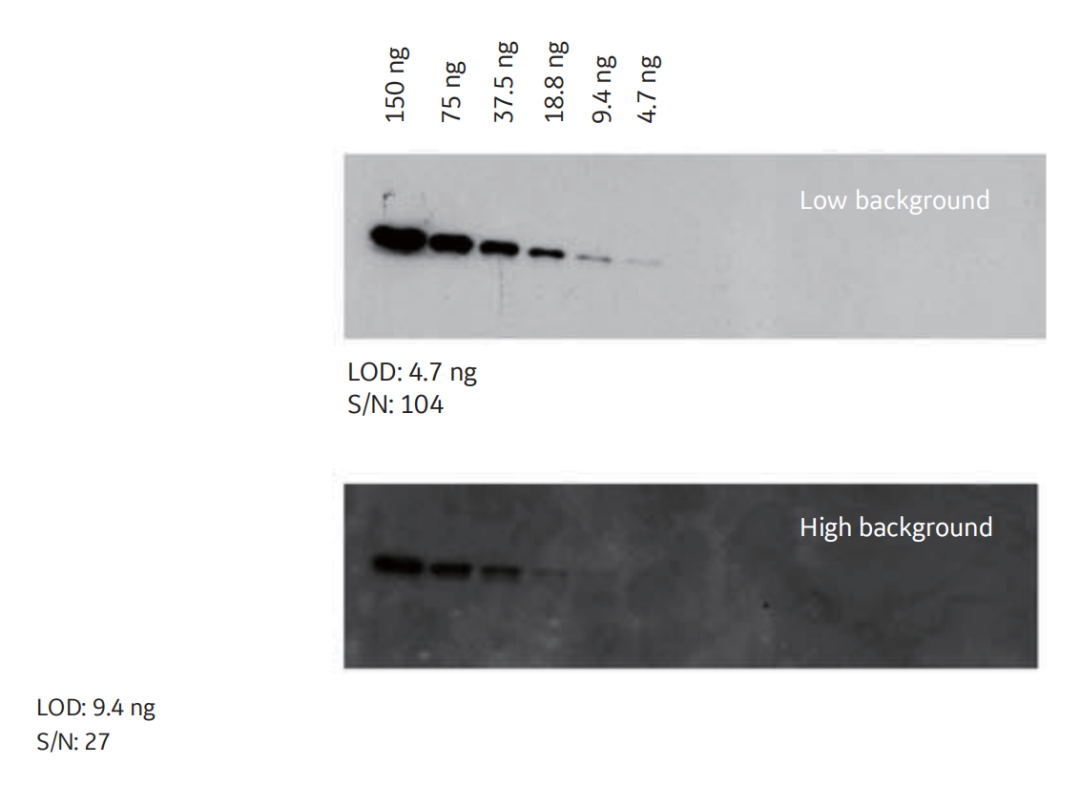
图8 使用Amersham ECL发光液在印迹膜上检测两倍连续稀释的肌动蛋白。背景水平升高严重影响定量。上图所示的信号是优化过抗体浓度获得的。下图为未优化的抗体浓度。其结果明显可见一个更高的背景,会影响了检出限LOD和信噪比。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












