【Cytiva】WB实验流程之荧光
当荧光基团分子吸收光时,会出现荧光现象。基态时,荧光基团不发光,但是光源激发时,它们的能级会跃迁至短暂但不稳定的激发态。当荧光基团返回到它们的基态时,它们以比激发光更低的能量、更高的波长(发射)释放光。
荧光检测是将二抗与荧光基团结合的直接方法,无需检测试剂的辅助。不同的荧光基团可用来检测可见光波长或近红外波长的信号。荧光检测方法灵敏度高,线性动态范围宽,非常适合定量检测。此外,可以同时检测多个蛋白(多重检测),适用于蛋白翻译后修饰等应用。
与Amersham CyDye荧光染料结合的抗体在可见光光谱中具有它们自己的特定激发和发射波长,并且在光谱上彼此远离,交叉干扰极少(见图1)。
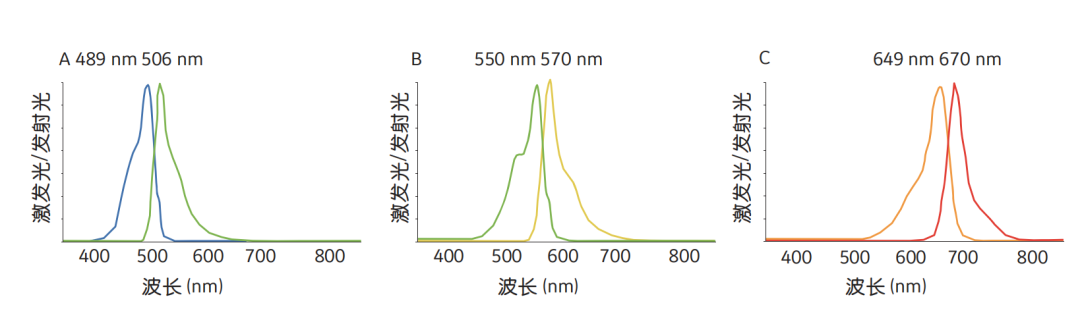
图1 荧光染料CyDye(A)Cy2、(B)Cy3和(C)Cy5的激发和发射光谱。每个示例各自展示了最大激发效率波长的影响。
激发光激发后,使用多通道荧光扫描仪(如Typhoon)或基于CCD相机的成像仪(如配备有合适光源和发射光滤光片的Amersham Imager 680系列)捕获荧光发射信号。
CyDye的优点是它们比其他荧光基团,如荧光素具有更高的光稳定性。此外,CyDye的高pH耐受性(3-10)使它们与大多数WB缓冲液兼容。其他优势包括实验处理步骤少和信号维持时间长(>3个月),能够比较许多实验的数据。
荧光检测非常灵敏,具有较宽的动态范围。图2中所示,用Cy3标记的二抗在检测限度为1.2pg时进行转铁蛋白稀释系列的检测。
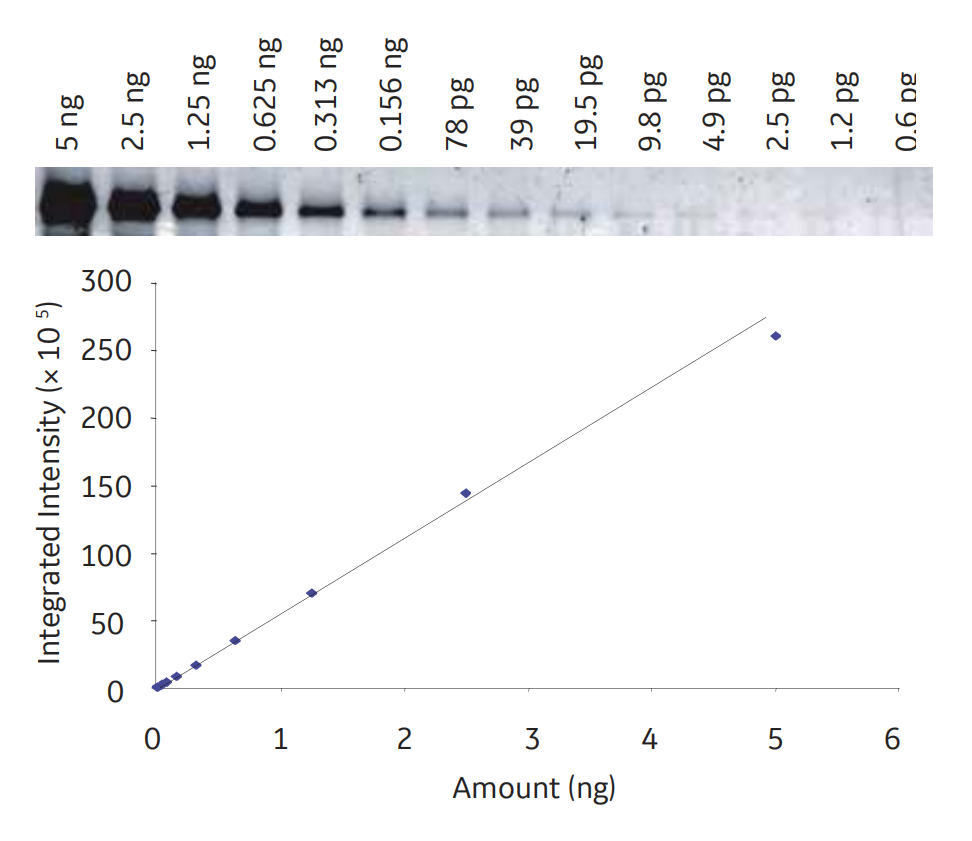
图2 荧光检测提供了宽的线性动态范围,使得在同一膜上检测弱带和强带成为可能。这是用Cy3标记的二抗(Amersham ECL Plex)检测的转铁蛋白稀释系列。动态范围是3.6个数量级,LOD为1.2pg,检测结果线性好。
基于荧光的检测方法推荐作为:
• 同时检测多种蛋白(多重性)
• 检测具有相同分子量的蛋白
• 定量WB检测应用
• 需要高灵敏度的应用
• 蛋白丰度的变化
• 蛋白和蛋白的互作
• 检测异构体
• 蛋白降解的评价
• 蛋白翻译后修饰
• 同时研究低丰度和高丰度蛋白
GE 提供 Amersham ECL Plex用于荧光检测。
多通道检测
多通道检测需要不同种属来源的一抗。该技术便于研究相似大小的蛋白或检测蛋白翻译后修饰水平,因为这些研究不需要剥离和重新孵育膜(如前所述,剥离和重新孵育膜存在蛋白质从膜上不均匀损失的风险)。因此,多重检测技术提高了蛋白质印迹的定量分析能力。它适用于所有类型的定量,因为不需要剥离抗体来监测看家蛋白的水平。荧光检测的优点,如高灵敏度、宽线性动态范围的覆盖、以及稳定的发射光都是有助于定量分析的因素。
图3展示了一种多通道荧光检测的方法,用于蛋白翻译后修饰(PTM)的分析中。利用总蛋白量进行上样量监控的另一种方法是通过荧光预标记样品(Cy5,Amersham快速染色标记试剂盒)。由于染料可共价地附着在蛋白上,因此它可被转移到膜上,而且可以用Cy3检测特定目的蛋白的上样量。
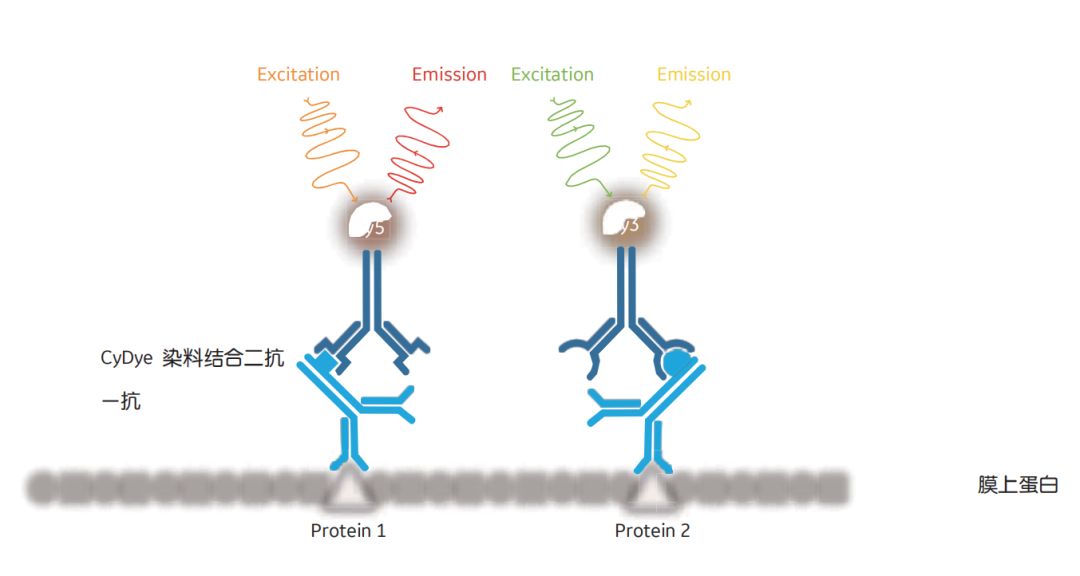
图3 该图显示了多通道检测的原理。两种蛋白的一抗,分别由Cy3和Cy5荧光染料结合的二抗所识别。直接荧光检测减少了处理和成像步骤,节省时间且减少定量误差。
Amersham ECL Plex
Amersham ECL Plex二抗用Cy3或Cy5 CyDye荧光染料标记。它们可直接与兔和小鼠的一抗结合(图4)。此外,可以使用Cy2、Cy3或Cy5抗体标记试剂盒标记感兴趣的特定抗体。通过使用Cy2标记的二抗,可以在同一张膜上检测三种蛋白(三重检测)。
Amersham ECL Plex Fluorescent Rainbow Markers在Cy5和Cy3通道都可检出荧光,因此适合于监测电泳的进展、转膜效率以及印迹膜上蛋白的分子量估计。对蛋白表达的微小变化的研究,例如结合生长因子后细胞内信号分子的表达分析,只有在严格控制蛋白上样量时,结果才是可信的。尽管可通过总蛋白定量来精准控制不同泳道的上样量,但由于移液器误差或样品间总蛋白量变化的误差,难以实现准确的上样。
在监测总蛋白水平的同时,检测目的蛋白变化的一种方法是在抗体孵育前,首先对膜进行染色。该染色可用于定量每个泳道的蛋白上样量,并且可确认转膜效果。另一种方法是用Cy5对样品进行预标记。
为了获得最高的精度,蛋白水平应该通过与稳定的内部标准、看家蛋白、或者预标记样品的总蛋白信号相比较来定量。GAPDH或β-actin等看家蛋白,不管外部刺激如何,其表达水平相对恒定,但看家蛋白选择前需要验证。验证后,看家蛋白可以作为每个泳道蛋白上样总量的参考指标(图4)。Amersham ECL Plex的多重检测方法可帮助进行归一化实验,校正泳道间上样量差异。
由于看家蛋白有时会受实验条件的影响,因此建议使用总蛋白归一化(图4)
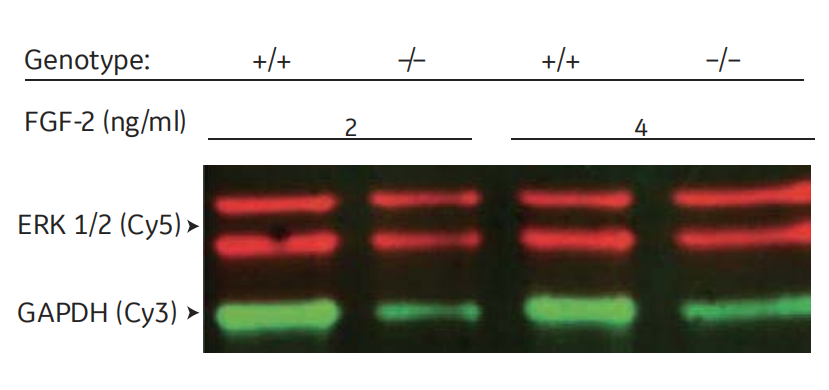
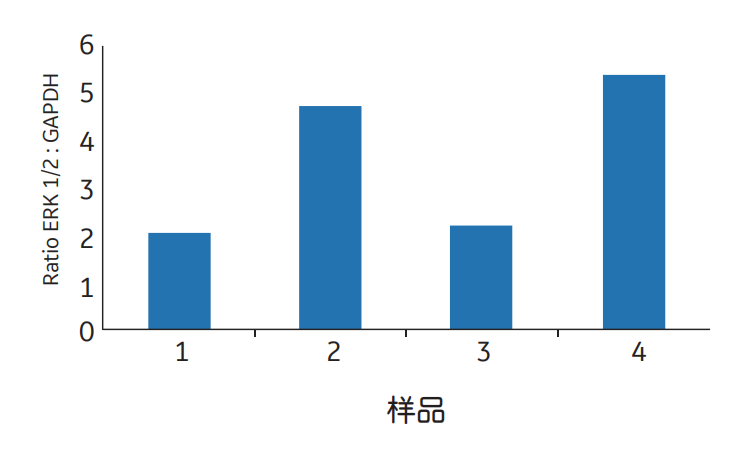
图4 通过检测同一印迹膜上的两个蛋白,蛋白表达可以通过内参蛋白如甘油醛3-磷酸脱氢酶(GAPDH)归一化进行定量。这张图显示Amersham ECL Plex检测野生型(+/+)和酶敲除(-/-)小鼠胚胎成纤维细胞中ERK 1/2,以反应纤维细胞生长因子-2(FGF-2)处理后的表达变化。ERK1/2和GAPDH分别于特异性一抗结合,然后与Cy5(红色)或Cy3(绿色)标记的二抗结合。ERK1/2:GAPDH比值反映了ERK1/2的表达情况,并且与样品上样量的变化无关。数据由李金平博士和贾娟博士提供,医学生物化学和微生物学系,瑞典乌普萨拉。
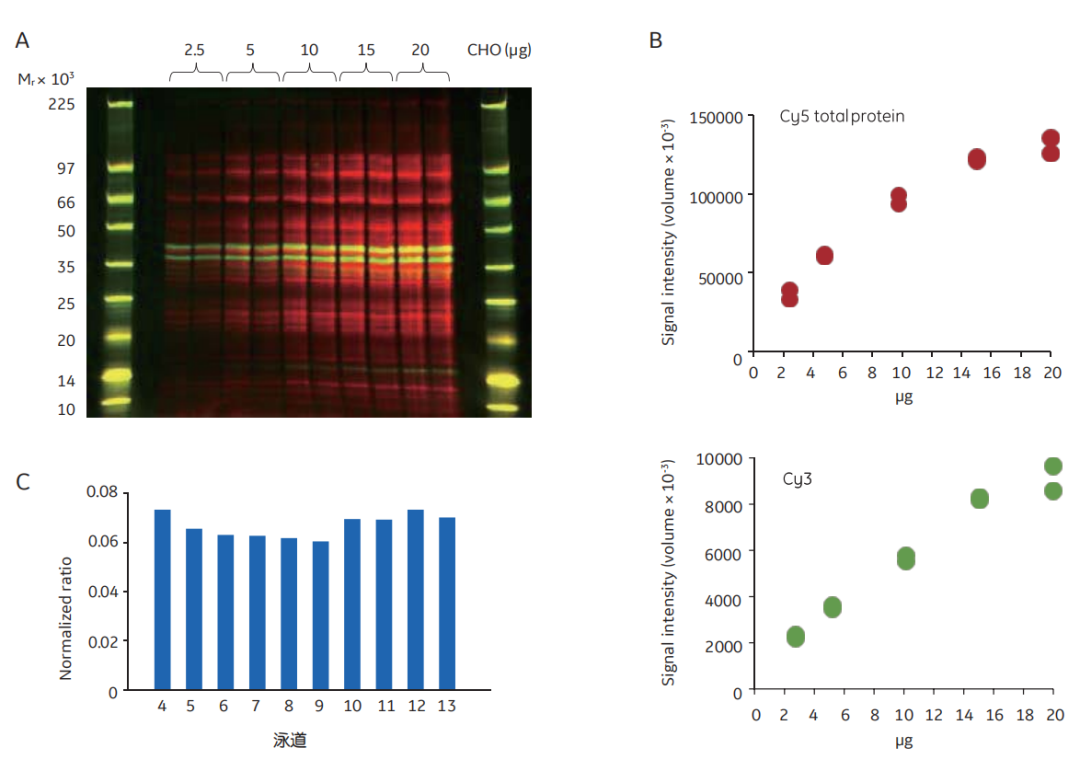
图5 用Cy5总蛋白荧光染色进行归一化实验。用Cy5预标记不同量的CHO细胞裂解液,并经WB检测。用抗ERK1/2一抗和Cy3标记的二抗(A)对膜进行检测。尽管上样量有很大变化,目标Cy3和对照Cy5信号成比例(B),相同样品的Cy3/Cy5的归一化比值(C)与预期相同。
使用传统的WB检测技术很难对蛋白分子量没有发生变化的蛋白翻译后修饰实验进行研究。需要剥离及再孵育过程,很难避免蛋白损失以及定量分析的不准确性。Amersham ECL Plex提供的多通道荧光检测方法可帮助检测同一张膜上的修饰和未修饰蛋白,使用不同种属的一抗结合不同形式的蛋白(如磷酸化蛋白和非磷酸化蛋白),再使用种属对应的结合Cy3和Cy5染料的二抗进行检测。
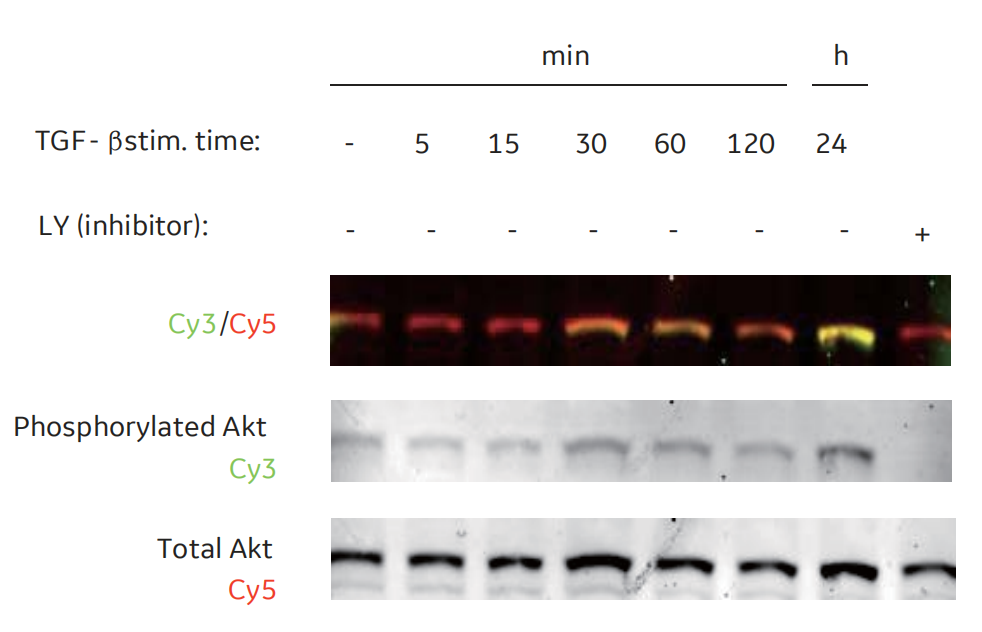
图6 用Cy5总蛋白荧光染色进行归一化实验。用Cy5预标记不同量的CHO细胞裂解液,并经WB检测。用抗ERK1/2一抗和Cy3标记的二抗(A)对膜进行检测。尽管上样量有很大变化,目标Cy3和对照Cy5信号成比例(B),相同样品的Cy3/Cy5的归一化比值(C)与预期相同。
使用低荧光背景PVDF Amersham Hybond LFP 0.2或硝酸纤维素Amersham Protran Premium 0.2膜可以展现Amersham ECLPlex发光液的最佳性能,Hybond P 0.45也与荧光检测兼容。关于封闭液,推荐使用Amersham ECL Prime封闭液或BSA(牛血清白蛋白) 来降低背景噪声。抗体应按照厂家推荐的浓度进行稀释,但作为Amersham ECL Plex的指南,一抗和二抗应分别从1:100至1:5000和1:1250至1:4000进行稀释,需要花时间优化抗体浓度
荧光检测技巧及提示
为了获得高质量的Western blotting结果,以下几点有助于解决低信噪比相关的问题。
●使用Amersham ECL Plex Cy5-偶联二抗检测样品中最低浓度的蛋白。Cy5发出的信号比Cy3发出的信号稍微强一些。
●如果来自marker的信号过强,强于低丰度蛋白质的信号,那么最好使用少量的Amersham ECL Plex Rainbow Markers(1.5 μL)。可以在marker和样品之间的单个泳道中点上样缓冲液(loading buffer)。
●Amersham Typhoon扫描成像仪对荧光信号高度敏感,蛋白检测线性动态范围较宽。由于灵敏度和动态范围也是抗体与蛋白结合的重要参数,因此优化一抗和二抗的浓度也是至关重要的。
●荧光污染会造成荧光检测背景信号不均匀,需要确保所有的材料都非常干净。
--从膜上去除残留的凝胶碎片。
--膜上溴酚蓝(BPB)的存在会产生荧光信号干扰。在蛋白转印到膜上之前,从SDS-PAGE凝胶的底部去除所有BPB。
--确保托盘、镊子和容器干净,没有考马斯亮蓝的污点,这也可能造成背景问题。
--避免用圆珠笔在膜上作标记,这也会产生污染。剪掉膜的一个角,并做记录!
--不要用手接触膜;使用干净的镊子。
--处理薄膜时要戴无粉手套。实验室手套上的粉尘可以发荧光,也可能散射光,影响成像结果。
●如果存在明显的非特异性蛋白条带,尝试Amersham Hybond LFP 0.2膜。Amersham ECL Prime封闭液可降低非特异性结合,这个问题常常与一抗的选择有关。此外,一抗的稀释度会影响特异性,优化抗体浓度很重要!
●在封闭液中孵育一抗有助于减少非特异性结合并增加信号强度。在封闭液中稀释的一抗相比洗液中稀释的一抗会产生更强的信号,即使抗体稀释浓度低很多的情况下。
●吐温-20浓度大于0.1%时,可明显提高PVDF膜的背景。
●如果使用荧光染料偶联的抗体
--抗体分装在避光的小管中。
--抗体在避光容器中进行稀释。
--二抗孵育时避免光照。
●成像前,使用PBS冲洗膜以去除吐温-20
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












