【Merck】超滤产品选择指南
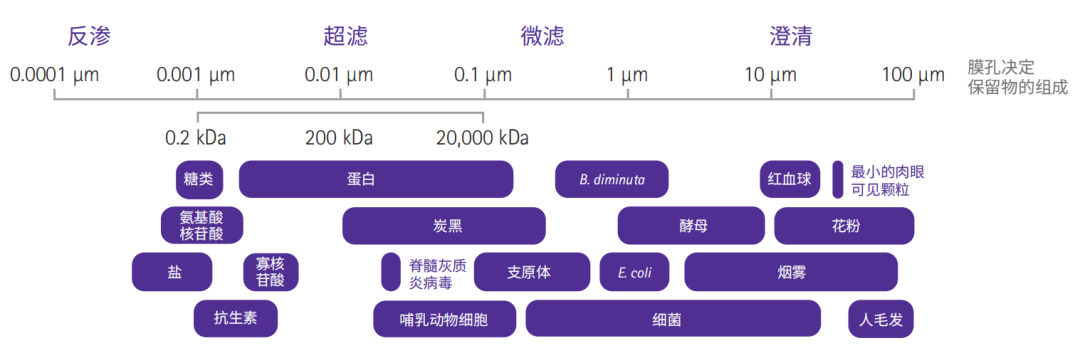
膜分离技术概述
用膜来对样品进行处理好处很多,操作简便,效果稳定可靠,成本效益高。实践中选择膜材质及相关装置时,主要要考虑处理样品的性质、处理量及要求的处理效果等;选择最合适的装置时,还要考虑样品的体积和装置的动力设计,比如真空或加压配套设备等。
微滤
微滤(MF)是使用微孔膜介质(即常见的滤膜),将大小在 0.025μm 到 10.0μm 之间的颗粒物或生物体从溶液中除去。虽然某些非膜材质或深层介质(如厚的玻璃纤维)也能够去除颗粒,但只有滤膜具有精确的孔径才能实现比较准确的截留。在细胞培养实验中,微滤最常被用来做样品的除菌处理(0.1μm 微滤可以去除支原体等);在核酸和蛋白分析之前,也需要用微滤除去细胞裂解液中的完整细胞和细胞碎片。用于这类分离的膜孔径一般在 0.05μm 到 1.0μm 之间。

深层过滤介质(左)内部结构松散、排列无序,通常用于去除大颗粒物的预过滤。
微滤膜(中)由规则、连续的网状多聚物构成,具有精确的孔径,用来截留细菌、胶体及微小颗粒。
超滤膜(右)通常有两个明显的分层:致密的表层,厚 0.1-1.5μm,孔径 10-400Å;下层是多孔支撑物。超滤膜依赖生产工艺严格控制膜孔径规格,用于生物大分子样品处理,应用多样。
常见默克密理博微滤产品举例
(细胞培养基、添加剂过滤除菌)
超滤
超滤(UF)常用于分离溶液中极其微小的颗粒和不溶分子。虽然分离效果受到包括化学性质、电荷等多种因素影响,这种方法主要还是以分子大小为最基本的考虑。超滤膜截留1-1000kDa(MW)的分子,盐和水等小分子会透过,因此在大分子样品处理中得到了广泛应用。胶状或微粒状物质也能够被截留。UF膜既可以用于透过样品也用于保留样品的纯化。样品显著小于膜孔径,则经过膜处理可以达到除热源、澄清和与大分子污染物的分离的效果。如果目的分子远远大于膜孔径,膜处理则可以将小分子污染物去除而目的分子被浓缩。超滤方法相比沉淀法对于样品更温和,没有发生容易导致生物大分子失活的相变,而且在浓缩的同时可以完成对溶质的除盐。超滤的应用不限于蛋白样品的操作,也常用于核酸样品制备,包括分子克隆和质粒纯化。DNA和RNA样品起始浓度低至5ng/mL也可以被高效地在数分钟内被浓缩,回收率达到99%以上。
离心方式的超滤方法进行溶液置换也被称为“渗滤”,操作时样品首先被浓缩,继而加入新的溶液,再次浓缩时,原溶液已经被换成选定的溶液。
超滤相关常见术语
化学相容性与溶出
样品的化学背景有时很多样而复杂,过滤的过程中很重要的一点是操作过程不应给样品带来新的污染。所以滤膜和装置与样品接触的其它部分都不能与样品中的化学成分发生反应而产生溶出污染。关于默克密理博各种微滤、超滤产品的化学相容性请参考产品使用说明书或垂询技术支持专线 400-889-1988-2 分机。
回收率及其重要性
超滤的最终目的常常是最大程度地回收目标溶质,但膜的很多特性会对这一目的产生影响。影响回收的因素包括:
• 标称分子量限制(NMWL)/ 核酸截留分子量(NCO)
• 截留 • 浓差极化 • 通量
标称分子量限制
微滤中膜的孔径大小通常以微米计,表示大于这一规格的颗粒将被膜截留。超滤膜根据 NMWL 分级,有时也用截留分子量(MWCO)。
NMWL 表示大多数大于这个值的分子将在超滤时截留。一个确定NMWL 的超滤膜应该截留至少 90% 以上的这个大小的球形分子。但为了保险起见,实践中选择的膜孔径要小于目的分子。缓冲液置换时膜截留分子量应该充分大于流过的溶质。当膜材料相同时,孔径减小会增加排阻而减小滤过率。截留及产物回收的影响因素包括分子的形状、带电性质、样品浓度及组成成分、操作条件、使用的设备构造等。
因此常常发生同样 NMWL 的膜对一定范围内的不同分子截留效果有一定差异的情况。使用超滤方法进行样品浓缩或除盐时,需要谨慎地选择合适的 NMWL 膜和设备。虽然影响因素较多,我们通常建议截留分子量约为目的分子分子量一半的膜,这样可以最大化样品的回收,同时节省过滤时间。
核苷酸截留分子量(NCO)
超滤膜的 NMWL 是用球形蛋白标定的,适合各种蛋白研究,但在核酸和多糖纯化时则要考虑更多因素。这些分子的棒状的三维结构容易漏过,相对于球形蛋白需要更致密的膜(截留分子量更小)。所以选择滤膜是更多考虑的是核苷酸长度而非分子量。
截留
截留有时也称为排阻。水合程度、离子和空间位置效应会导致分子量相近的分子表现非常不同的截留状态。许多生物大分子在不同的 pH或离子强度改变的情况下倾向于聚集或改变构象,因此其有效大小可能比 “天然” 分子大很多,从而导致排阻增加。比如,有些蛋白质在某些缓冲液条件下会发生多聚化,而另一些则发生解聚(如血红素蛋白)成亚基。这使选择合适截留分子量的膜变得复杂。以默克密理博的经验,我们通常推荐选择为目的分子大小一半的膜作为尝试的起点,再根据实际情况加以调整。
浓差极化
浓差极化实质是溶质累积在膜表面造成的堵塞,产生除了膜本身截留分子量以外的过滤限制。当溶质浓度较高时,会形成相当于第二层滤膜作用的胶体层,干扰分子通过滤膜,同时降低流速。pH 值、缓冲液的成分也会影响目的分子的状态而使浓差极化现象加剧或减轻。
通量(超滤效率)及其影响因素
超滤过程中需要在速率和回收率之间平衡以期获得最好的效果。滤膜的通量的定义是流量除以面积,使用高 NMWL 滤膜可以增加通量,但同时会降低回收率。选择膜和装置时需要同时考虑截留分子量和通量。而参与影响通量的因素很多,包括:压力:较为稀释的蛋白溶液或胶体悬液进行超滤时,流量随着跨膜压力(TMP)的增大而增加。正压条件下操作,如 Stirred Cell 搅拌式超滤杯,这种因素影响较为明显。如果极化影响显著,通量会达到一个平台,甚至可能随着压力的增加而降低。
浓度:当需要截留的样品浓度很低时,通量通常不受浓度影响。操作过程中,随着溶质浓度的升高,增加的粘滞性和极化将导致通量降低。
温度:通常增加操作时的温度可以提高超滤效率。每增加 1℃蛋白扩散率增加 3-3.5%,同时溶液粘度降低。实践中一般是以样品和设备能耐受的最高温度来操作。
pH:改换溶液和 / 或 pH 常常改变分子结构,蛋白尤其如此。在蛋白的pI 值蛋白会沉淀,产生堵塞和得率损失。
污垢:溶液中除了目的分子造成的浓差极化,还有其它小颗粒和分子会在膜上富集和沉淀,逐渐堆积在膜孔上或膜孔结构中,形成结晶和沉淀。
操作模式
常规溶液过滤(NFF): 液体在压力或真空驱动下直接流过膜。大的颗粒物被膜截留并堆积在膜上,小分子则通过膜流出。NFF 常用于无菌过滤、澄清预过滤及病毒 / 蛋白样品制备等。
切向流过滤(TFF): 液体流过时与膜表面呈一定角度,被膜阻挡的大颗粒物不会累积在膜表面,而且还会被切向流从膜表面扫除,因此 TFF 成为按分子大小不同分离的主流方法。TFF 在大体积样品处理中是主要的操作方法,而现在,TFF 技术被用于 Amicon® Ultra 离心式超滤管的设计中,使小体积样品的浓缩和分离操作也变得更加方便。
膜的吸附损失
对于浓度很低及珍贵的样品,除了考虑截留效率和操作方便外,额外要关注的是采用的超滤膜及设备对目标蛋白的潜在非特异性吸附损失。不同膜材质对生物分子吸附程度不同,默克密理博的 Ultracel®再生纤维素膜在各类膜中对生物分子吸附最小,是 Amicon® Ultra超滤管等超滤产品成为首选关键之一。滤膜和装置表面对溶质的吸附对样品收率会产生直接影响,所以如果希望尽可能提高得率,就应该考虑采用较小的设备和膜面积。小量的、较为稀释的样品应该选用膜面积小的装置,同时保证一定的流速。默克密理博设计了一系列离心式或搅拌式装置,配合不同的膜面积、不同的截留分子量的切向流系统,支持您获得理想的处理效果。
用超滤对分子进行分级
通过超滤操作精确地将混在大分子中的小分子去除的想法常常不切实际。事实上,膜的规格描述是基于截留而非通过的性质。一项实验结果 显 示,采 用 100k NMWL 滤 膜,大 于 100kDa 的分子截留率>90%,但 这 时 比 膜 孔 径 小 的 分 子 并 不 是 完 全 自 由 地 通 过 滤 膜,75kDa 的分子截留率为 83%,30kDa 的分子也有 32% 被截留。混合的溶液中的各种成分通过膜并不像单一成分的溶液那么简单和容易。实践中,如果要分离两种大分子,它们之间的分子量差异应该达到 10倍以上,或至少膜的 NMWL 规格在两种蛋白之间,则可达到比较理想的分离。如果蛋白溶液较为稀释,低压下操作也有助于达到更好的效果。
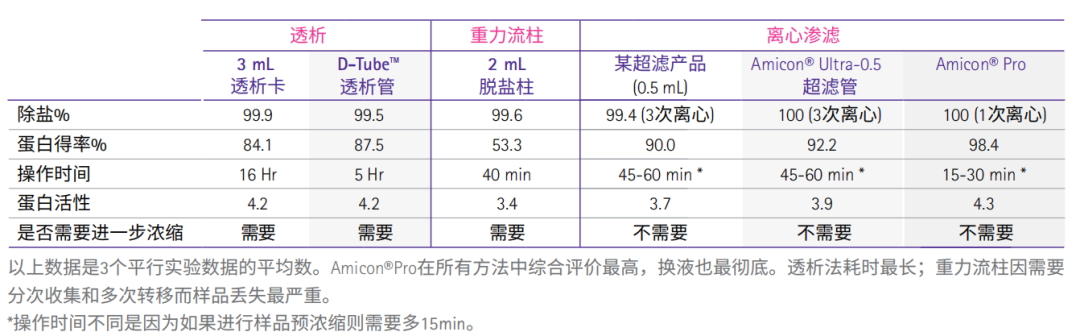
比较几种常用的蛋白浓缩/脱盐方法的利弊
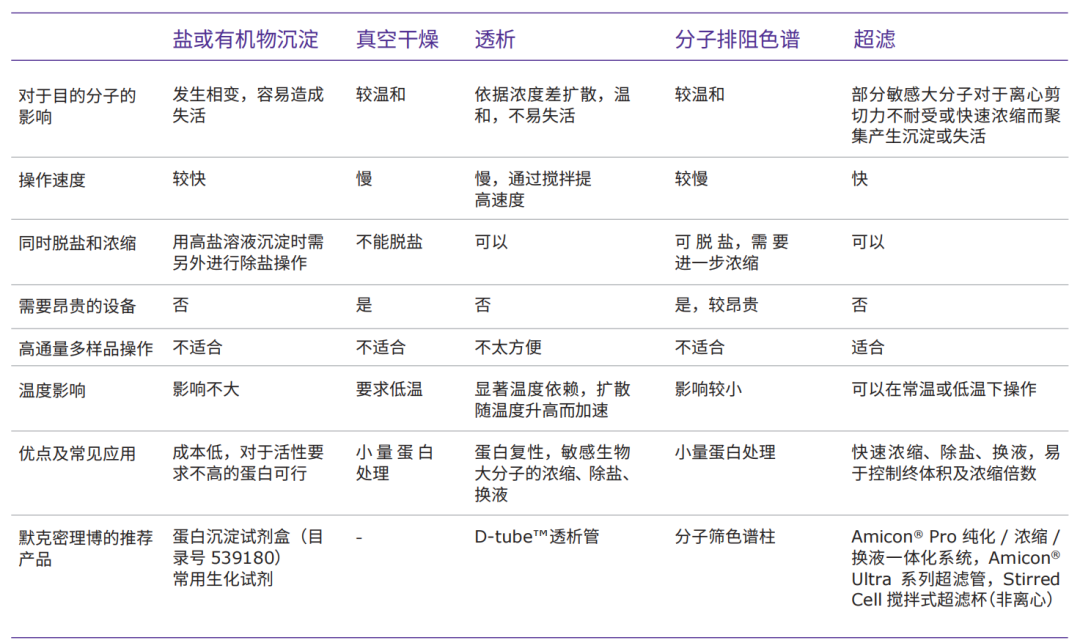
活性蛋白除盐:几种常用工具使用效果的比较
超滤产品选择指南
按样品体积选择浓缩产品
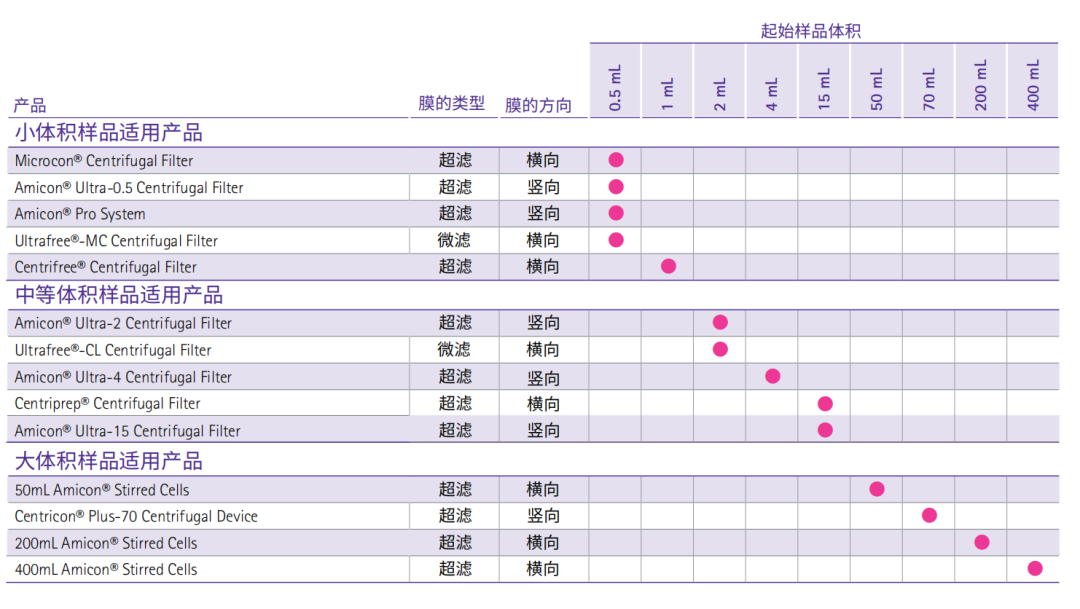
超滤膜选择指南
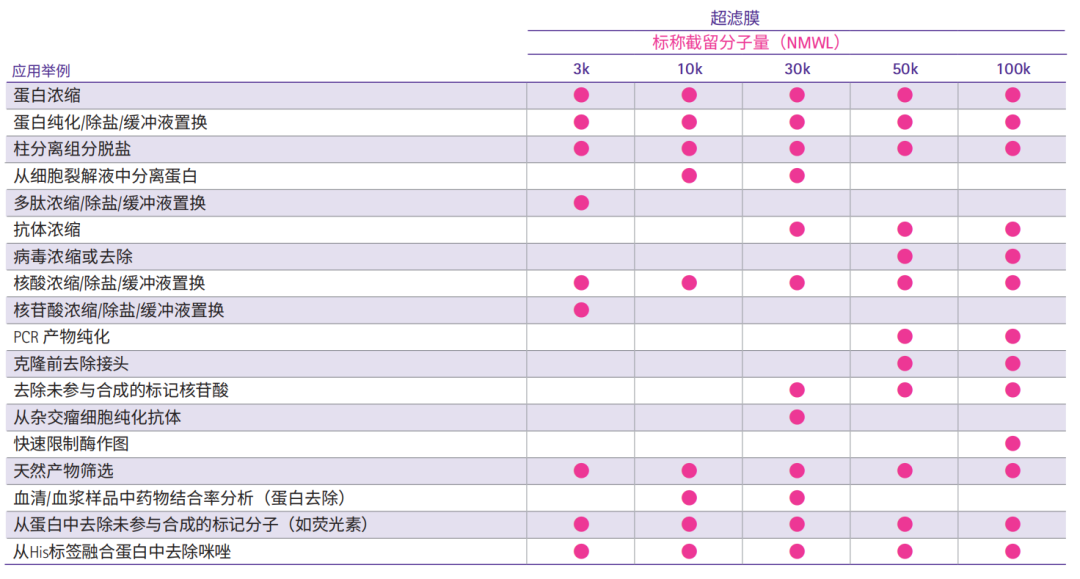
Amicon® Ultra超滤管选择指南
Amicon® Ultra系列超滤管产品需要根据起始样品体积、目标蛋白或核酸的分子量、终体积及浓缩倍数等选择具体型号。下表为选择最适合截留分子量的超滤管提供了一些参考建议。默克密理博设计了网上快捷选择指引工具,请登录以下网站,选择最适合您的超滤离心管:http://www.merckmillipore.com/US/en/20130916_185742
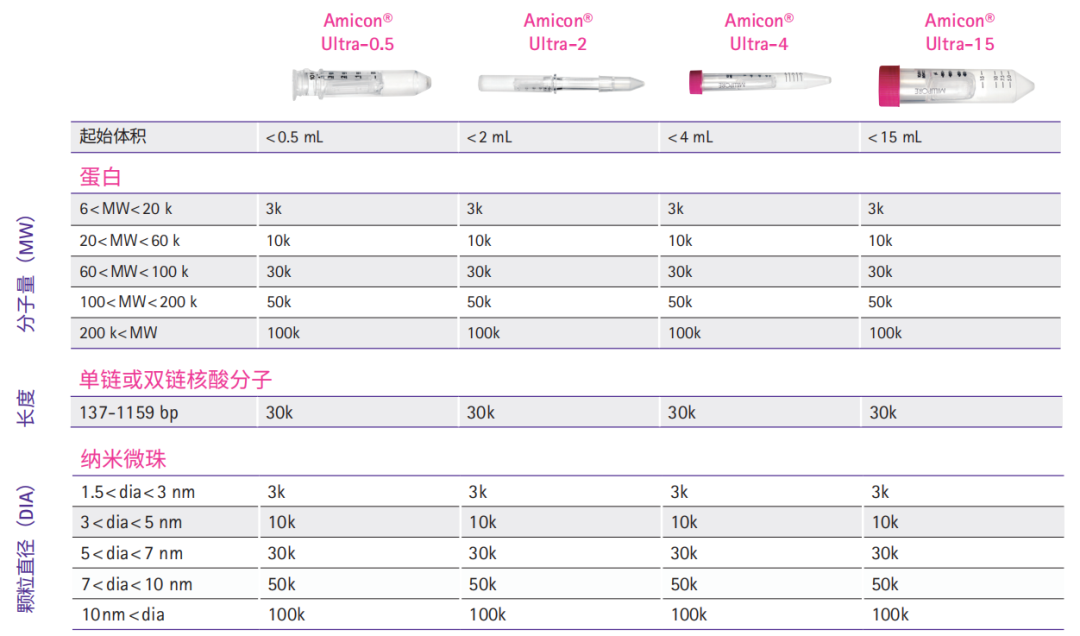
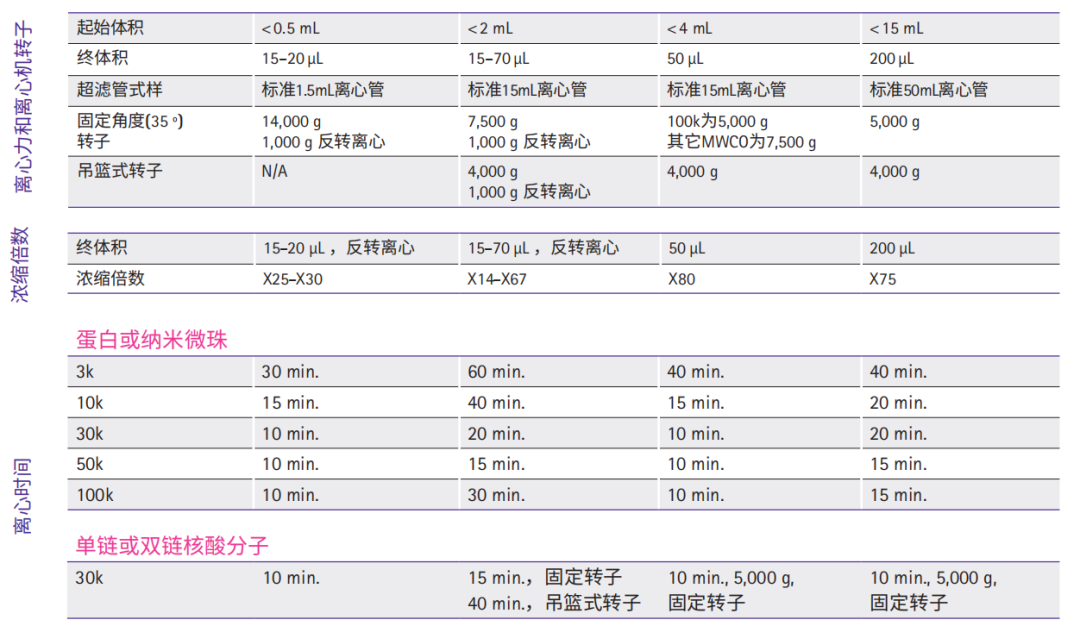
MWCO:截留分子量
10k MWCO Amicon® Ultra-4 和 -15 超滤管在美国注册 用于体外诊断样品制备。
查看Amicon® Ultra超滤管离心机转子要求及化学兼容性等详细信息请访问 www.merckmillipore.com/psp
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味