【Merck】蛋白质含量测定:二喹啉甲酸法(BCA法)
蛋白质含量测定是实验室最常用、最基本的分析方法之一。目前常用的方法有凯氏定氮法、双缩脲法、紫外吸收法、Folin-酚试剂法(Lowry法)、考马斯亮蓝法(Bradford法)和二喹啉甲酸法(BCA法)。
二喹啉甲酸法(BCA法)
原理:
在碱性环境下蛋白质分子中的肽键结构能与Cu2+络合生成络合物,同时将Cu2+还原成Cu+。而BCA试剂可敏感特异地与Cu+结合,形成稳定的有颜色的复合物,在562nm处有最高吸收峰。颜色的深浅与蛋白质浓度成正比,可根据吸收值的大小来计算蛋白质的含量。
特点:
1. 优点是灵敏度高,与Lowry法相比几乎没有干扰物质的影响,反应简单,终产物稳定。
2. 缺点是反应时间较长。
下面介绍具体实验方法:
需要的耗材及设备
• BCA蛋白定量试剂盒(货号71285-3)
• BSA标准品
• 分光光度计
• 小试管或96孔板
操作指南
一、制备BSA浓度标准曲线
按下表制备各稀释梯度的BSA标准液。每个标准液都需要使用一个新的试管。建议采用与蛋白样品一样的缓冲液来稀释、配制BSA标准液。如果缓冲液中有干扰BCA法的成分,则用去离子水替代样品的缓冲液。
表3.制备浓度梯度BSA标准液
管号 | BSA的体积 | 稀释液的体积 | BSA的终浓度 |
1 | 从2mg/ml溶液中取250μl | 250ul | 1000ug/ml |
2 | 从管1中取250μl | 250ul | 500ug/ml |
3 | 从管2中取250μl | 250ul | 250ug/ml |
4 | 从管3中取300μl | 300ul | 125ug/ml |
5 | 从管4中取100μl | 400ul | 25ug/ml |
6 | 0 | 400ul | 0ug/ml |
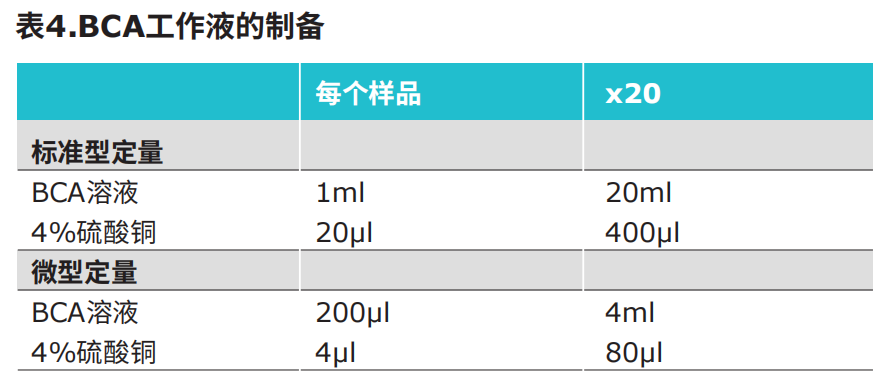
二、BCA蛋白定量的工作液的制备
按下表制备BCA工作液。工作液是以50份的BCA反应液与1份4%硫酸铜混合而成。注意:标准型测定的BCA工作液的体积是每反应1ml;这对于小吸光杯(0.7ml)足够了,如果采用较大的吸光杯,则需要3ml以上的BCA工作液。
定量的操作步骤
以下提供了2种定量操作:标准型定量需要的蛋白样品较多(50μl),这种情况下BCA工作液与蛋白样品的体积比是20:1,干扰定量的物质的影响会较小;微型定量需要的蛋白样品量较少(25μl),非常适合96孔板式的高通量操作。此种情况下BCA工作液与蛋白样品的体积比是8:1,干扰定量的物质的影响相对会较大。
三、标准定量操作
1. 吸取50μl标样或样品到标记好的试管中。
2. 加入1ml BCA工作液,轻柔涡旋混匀。
3. 标准检测:在37°C孵育30min或室温放置2–16h。加强型检测:在60°C孵育15min。
4.将试管冷却至室温。
5. 在一个干净的吸光杯中加入1ml水,在波长562nm调零。
6. 将待测液加入干净的吸光杯。
7. 10min内测定并记录所有反应液的吸光值(A562)。
8. 校正的吸光值是将各标样和试样的读数减去空白样吸光值。
9. 结合已知的BSA标样的量和校正过的吸光值画出标准曲线。
10. 参照标准曲线,根据各蛋白试样的校正吸光值,在标准曲线的线性范围内读出各样品的蛋白浓度。
11. 根据样品体积和稀释度计算原来样品中的蛋白量。
四、微型定量操作
1. 吸取25μl标样或样品分别加入到96孔板的各孔中。
2. 每孔加入200μl的BCA工作液。摇晃混匀30s,盖住各样品孔。
3. 标准检测:在37°C孵育30min或室温放置2–16h。加强型检测:在60°C孵育15min。
4. 冷却至室温。
5. 在562nm读吸光值。
6. 校正的吸光值是将各标样和试样的读数减去空白样吸光值。
7. 比照已知BSA量制作的标准曲线读取蛋白浓度。
8. 参照标准曲线,根据各蛋白试样的校正吸光值,在标准曲线的线性范围内读出各样品的蛋白浓度。
9. 根据样品体积和稀释度计算原来样品中的蛋白量。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味