【Merck】蛋白质含量测定:考马斯亮蓝法
蛋白质含量测定是实验室最常用、最基本的分析方法之一。目前常用的方法有凯氏定氮法、双缩脲法、紫外吸收法、Folin-酚试剂法(Lowry法)、考马斯亮蓝法(Bradford法)和二喹啉甲酸法(BCA法)。
考马斯亮蓝法(Bradford法)
原理:
考马斯亮蓝法(Bradford法)是1976年由Bradford建立的一种蛋白质测定法。该方法中利用考马斯亮蓝G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置由465nm变为595nm,溶液的颜色也由棕红色变为蓝色。该染料主要是与蛋白质中的碱性氨基酸(尤其是精氨酸)和芳香族氨基酸残基相结合。在595nm下测定的吸光度值与蛋白质浓度成正比。
特点:
1.优点是快速(反应时间仅需2min)且灵敏度高,几乎没有蛋白损失。
2.缺点是用于不同蛋白质测定时有较大偏差,并且去垢剂等物质可对测定结果造成干扰。
下面介绍具体实验方法:
需要的耗材及设备
• Bradford试剂(考马斯亮蓝G磷酸甲醇溶液,货号B6916)
• BSA蛋白标准溶液(2mg/ml,货号P0834,或者1mg/ml,货号P0914)
• 分光光度计(可测量吸收值为595nm区段)
• 试管,13×100mm(货号CLS980013)
• 96孔板(货号CLS9017)及96孔板封板膜(货号Z369667)
• 3ml抛弃型塑料比色皿(货号C5291)
• 1ml抛弃型塑料比色皿(货号C5416)
操作指南
一、标准3.1mL体系定量操作
(适用于检测体积约0.1mL,浓度范围在0.1–1.4mg/ml蛋白样品)
在试管中进行这个检测。每管样品由0.1ml蛋白样品和3ml Bradford试剂混合而成。也可以直接在比色皿中向0.05ml样品中加入1.5ml Bradford试剂。
1. 温和混匀瓶中的Bradford试剂,并放置至室温。
2. 用与待测样品同样的缓冲液配制所需浓度的蛋白标准品。以2mg/ml或1mg/ml BSA蛋白标准品为起点进行倍比稀释(表1)。去离子水也可替代缓冲液,但蛋白样品缓冲液中任何干扰成分的影响不会被相应体现。蛋白标准品浓度范围为0.1–1.4mg/ml。做一个类似表1的标样测定表。
表1
管号 | 样品(ml) | BSA蛋白标准品(mg/ml) | Bradford试剂(ml) |
1 | 0.1 | 0 | 3 |
2 | 0.1 | 0.25 | 3 |
3 | 0.1 | 0.5 | 3 |
4 | 0.1 | 1 | 3 |
5 | 0.1 | 1.4 | 3 |
6 | 0.1 | 未知 | 3 |
采用1mg/ml标准品(货号P0914)或2mg/ml标准品(货号P0834)配制蛋白标准品。每管里有0.1ml已知浓度的标准品,空白对照(仅有缓冲液)或未知样品。
3. 在每个试管中加入3ml Bradford试剂后,温和充分涡旋混匀。每个试管中液体总体积为3.1ml。
4. 样品在室温下孵育5–45min。
5. 将样品转入比色皿。
6. 测量595nm吸收值。蛋白-染料复合物可以稳定达60min。所有样品都应在60min内记录吸光值,互相之间不超过10min。
7. 比对蛋白样品和标样的吸光值,参照标准曲线,得出未知样品的蛋白浓度(表2和图1)。
表2:分析数据样例
用测试得到的吸光值做一个表格
管号 | A595 | A595换算值 | 蛋白(mg/ml) | 稀释倍数 |
1 | 0.433 | 0 | 0 | 1 |
2 | 0.742 | 0.308 | 0.25 | 1 |
3 | 1.036 | 0.602 | 0.5 | 1 |
4 | 1.463 | 1.029 | 1 | 1 |
5 | 1.75 | 1.316 | 1.4 | 1 |
6 | 1.245 | 0.811 | 0.75 | 2 |
得到结果后,绘制标准曲线以确定未知样品中的蛋白浓度。比照595nm的Net Absorbance和蛋白标准品浓度(管1-5)。
图1 标准曲线
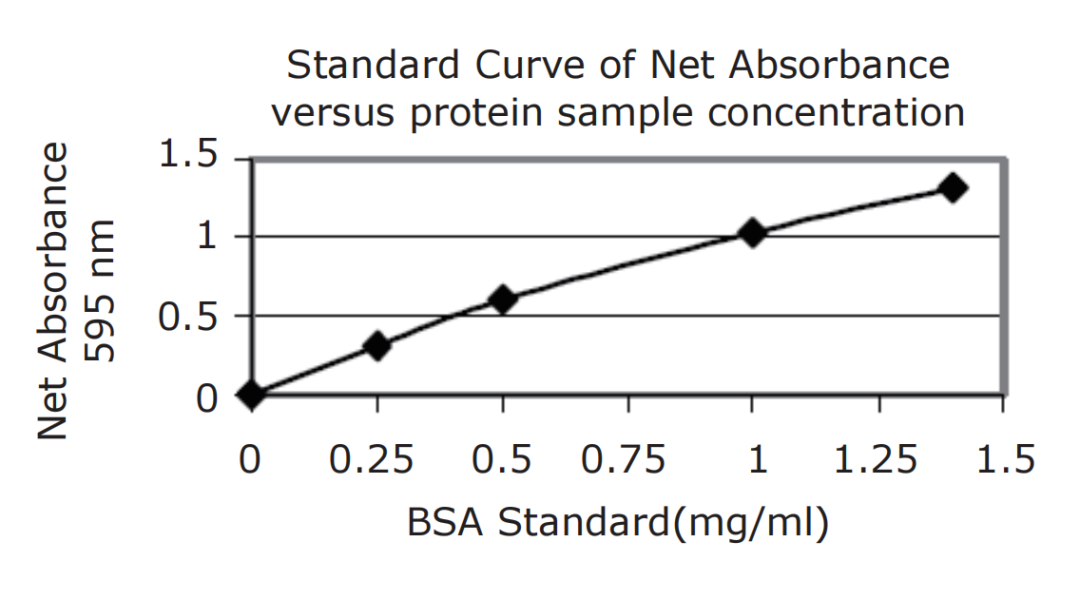
标准曲线提示未知蛋白样品试管6(Net A595 = 0.811)含有的蛋白浓度为0.75mg/ml。
原有未知蛋白总浓度计算:(mg/ml未知蛋白样品)乘以(稀释倍数),即(0.75mg/ml)×(2) = 1.5mg/ml
二、2mL小型定量操作
(适用于检测体积约1ml,浓度范围在1–10μg/ml蛋白样品)小型检测用于体积较大(至少1ml)的稀释样品。这个检测的线性浓度范围比标准或多孔板检测都低(1–10μg总蛋白/ml)。
1. 温和混匀瓶中的Bradford试剂,并放置至室温。
2. 用BSA或类同的蛋白标准品配制浓度1–10μg/ml范围的系列标准品。
3. 每个试管加入1ml蛋白标准品。在作为空白对照的管中加入1ml缓冲液。
4. 将待测样品配制成浓度处于1–10μg/ml,每管试管加入1ml样品。
5. 每管试管加入1ml Bradford试剂并混匀。
6. 样品在室温下孵育5–45min。
7. 将样品转入比色皿。
8. 测量595nm吸收值。蛋白-染料复合物可以稳定达60min。所有样品都应在60min内记录吸光值,互相之间不超过10min。
9. 比对蛋白样品和标样的吸光值,参照标准曲线,得出未知样品的蛋白浓度。
三、96孔板式定量操作
(适用于检测体积约5μl,浓度范围在0.1–1.4mg/ml蛋白样品)
这个检测在96孔板中进行。可以对小体积(5μl)众多样品进行快速检测。多孔板格式甚至可以进行自动化检测。
1. 温和混匀瓶中的Bradford试剂,并放置至室温。
2. 用BSA或类同的蛋白标准品配制浓度0.1–1.4mg/ml范围的系列标准品。
3. 在96孔板的不同孔中加入5μl蛋白标准品。空白对照孔中加入5μl缓冲液。
4. 将未知待测样品配制成浓度0.1–1.4 mg/ml。
5. 在加过样的孔中加入250μl Bradford试剂,摇晃混匀30s。
6. 样品在室温下孵育5–45min。测量595nm吸收值。蛋白-染料复合物可以稳定达60min。所有样品都应在60min内记录吸光值,互相之间不超过10min。
7. 比对蛋白样品和标样的吸光值,参照标准曲线,得出未知样品的蛋白浓度。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味