【Merck】His标签融合蛋白的亲和纯化
组氨酸残基侧链与二价阳离子(特别是Ni2+)有强烈的亲和力,由此建立的IMAC(固定化金属螯合层析)为重组蛋白纯化带来了极大的便利性。6×His标签仅为0.84kDa,可以克隆在目的蛋白的N或C端,在天然或变性条件下纯化,是大肠杆菌表达蛋白的主流纯化方法。
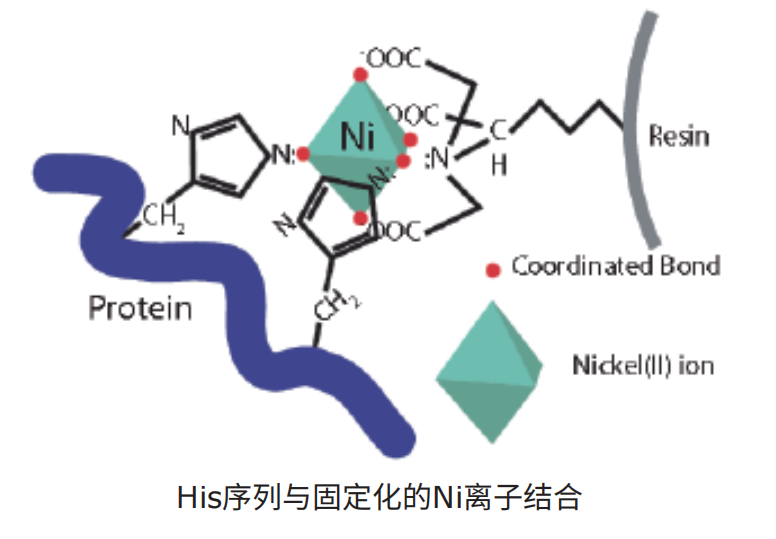
三类常见的His纯化基质如下:
●IDA琼脂糖:每次洗脱蛋白时Ni2+也会被洗下来,所以需要每次再生处理;耐受高浓度尿素,可用于包涵体纯化和复性;再生次数可达百次以上,经济性好。默克的代表性产品(货号70239)。
● NTA琼脂糖:预挂Ni2+而呈蓝绿色,与Ni2+结合牢固,减少渗漏使Ni2+对蛋白的催化氧化损害降到最低;不用每次使用后再生,一般可再生3~5次。Superflow耐压型可做高流速操作。默克的代表性产品(货号70666)。
● 磁珠:用于少量多样本纯化,操作方便,用于高通量快速表达筛选。默克的代表性产品(货号H9914)

下面介绍用NTA琼脂糖法亲和纯化His标签融合蛋白的操作方法:
需要的试剂及设备
• Ni-NTA His·Bind®树脂(货号70666)
• 表达His融合蛋白的细胞样品
• 大肠杆菌裂解液BugBuster Master Mix(货号71456)
• Ni-NTA 缓冲液试剂盒(货号70899-3)(天然条件纯化时需要)
• 离心机,纯化柱,离心管
• FPLC设备(若采用FPLC纯化方法)
• 变性及天然条件纯化用的裂解/结合/漂洗/洗脱缓冲液
操作指南
第一部分:样品的准备
(一)大肠杆菌
1.用经预先称重的离心管10,000g离心10min从液体培养体系收集细胞。如果是小规模培养(如1.5ml或更少),可以用1.5ml离心管14,000–16,000g离心。尽量倾去液体,称量细胞沉淀湿重。
2.室温下用吸打或温和涡旋使BugBuster Master Mix(货号71456)与细胞沉淀混匀,每克细胞糊需要5ml抽提试剂。这相当于50ml培养液采用2.5ml抽提试剂。如果是小规模培养,则采用约1/5培养体积的抽提试剂重悬沉淀。
3.室温下将重悬的细胞液在摇板或低速搅拌器上孵育10-20min。
4.4℃下16,000g离心20min以去除不溶的细胞碎片。如果需要,沉淀可以留作“包涵体纯化”(见以下说明)的材料。
5.将上清转入另一个新试管。这样抽提得到的可溶蛋白溶液可以直接上样于的纯化树脂(以及其它很多类似纯化系统)。蛋白溶液在冰上可以存放2-3小时,也可在-20℃长时间存放直至下步分析。蛋白抽提液应该根据目的蛋白的活性要求的温度存放,有些蛋白经冻融会失活。
(二)高纯度包涵体的制备
以下操作可用于任何BugBuster®系列产品抽提的包涵体纯化。
1.如上述可溶蛋白抽提步骤1-4进行操作。
2.将步骤“4”所得到的沉淀重悬于BugBuster(货号70584),BugBuster的量与当初重悬细胞糊的体积相同。吸打并涡旋以获得均匀的悬浮液。充分重悬沉淀能够溶解、去除杂蛋白以获得高纯度的包涵体。
3.加入rLysozyme™溶液至终浓度为1KU/ml。温和涡旋混匀,室温孵育5min。
4. 加入6倍体积的经1:10去离子水稀释的BugBuster重悬,涡旋1min混匀。
5.于4℃,5,000g离心15min,以吸管移去上清,收集包涵体。
6.将包涵体重悬于相当于原培养体系体积一半的经1:10稀释的BugBuster中,涡旋混匀,如步骤5离心。此步骤重复两次。再次重悬,于4℃,16,000g离心15min并去除上清。
7.重悬最终的沉淀(即纯化的包涵体)于选定的缓冲液,最好是能与后续纯化方法兼容的缓冲液
第二部分:亲和纯化
Ni-NTA His·Bind树脂不耐受高浓度还原剂,如DTT、DTE,这些还原剂会还原Ni离子,使其无法与His·Tag融合蛋白结合。被还原的树脂呈棕色。多数情况下,可以使用巯基乙醇,其浓度可以加至20mM。EDTA、EGTA或其它强螯合剂会与Ni2+结合,将其从树脂上剥离下来。Ni2+被螯合后,树脂呈白色。应尽量避免缓冲液中含有任何高浓度供电基团成分(如NH4+)、或裂解物中含诸如Arg、Gln、Gly、His等氨基酸。菌体应在无强螯合剂(如EDTA)、无强还原剂(如DTT)、无离子型去污剂(如SDS)的情况下裂解。
A.天然条件(非变性条件)纯化
在决定使用天然条件(非变性条件)进行蛋白纯化之前,首先需要确定蛋白是否可溶。即使目的蛋白大部分以不溶形式表达,仍有可能有少量可溶蛋白可以用 Ni-NTA His·Bind树脂纯化出来。在没有强变性剂,如尿素的情况下,细胞裂解物中部分不稳定的蛋白可能容易被降解。最好始终保持蛋白溶液处于低温(0-4℃),并快速操作。加入AEBSF或蛋白酶抑制剂混合物系列III (货号101500和539134),可能有助于蛋白的稳定,但是它们可能会对重组蛋白有影响。
(一)柱层析
1.将1ml 50% Ni-NTA His·Bind 树脂悬液加入到4ml 1×Ni-NTA结合缓冲液中,轻柔混匀。待树脂自然沉降后,用枪头吸去 4ml上清。
2.加入4ml制备好的裂解液,轻柔摇动棍匀(旋转混合器,200rpm), 4℃结合60min。
3.将裂解液Ni-NTA His·Bind树脂混合物加入下端封闭的空色谱柱中。
4.除去柱下端封闭盖子,收集流出液(穿过峰),保存用于SDS-PAGE电泳分析。
5.以4ml 1×Ni-NTA漂洗缓冲液漂洗2次,收集漂洗组分,用于SDS-PAGE电泳分析。
6.以0.5ml 1×Ni-NTA洗脱缓冲液洗脱目的蛋白4次。将洗脱组分分为四部分收集,并走SDS-PAGE电泳分析各保存组分。
7.1×Ni-NTA结合缓冲液、漂洗缓冲液和洗脱缓冲液的成分可以根据具体情况进行调整以满足实验者的具体需要,如加入0.1% Tween、5-10mM β-巯基乙醇、蛋白酶抑制剂混合物III、增加NaCl或甘油浓度等。
(二)FPLC纯化
若需纯化大量蛋白,可以使用FPLC设备,需配合Ni-NTA His·Bind Superflow 柱使用。Ni-NTA His·Bind Superflow的物理稳定性使其适用于较高压力和流速的层析方式。
1. 按 FPLC设备的安装要求,装好色谱柱。去除色谱柱的上端接头,关上柱下端开关。
2. 彻底重悬体积比为50% 的Ni-NTA His·Bind Superflow 树脂悬液,倒入空柱中。注意避免产生气泡。通过一根细玻棒,小心缓慢将树脂悬液加入空柱中。所需空色谱柱大小和树脂体积由待纯化的His融合蛋白总量决定。一般来说,Ni-NTA His·Bind Superflow的载量为每ml树脂5-10mg蛋白。
3. 使树脂沉降。通过打开柱下方盖子,使缓冲液流动,可以加快树脂沉降过程。也可根据具体需要使用蠕动泵,但流速不可超过2ml/min。请注意避免缓冲液流干。若发生这种情况,用裂解缓冲液重悬树脂并重新装柱。在树脂完全沉降前,可以加入更多树脂悬液以增加柱床体积。
4. 加入上端接头,调整至沉降树脂上端。避免引入任何气泡。装好的色谱柱可以接入FPLC系统流路中。
5. 以5倍床体积1×Ni-NTA结合缓冲液平衡色谱柱。流速不可超过2ml/min。280nm紫外监控,当用5倍床体积缓冲液平衡
6. 上样,以后,基线应稳定。1×Ni-NTA结合缓冲液漂洗至A280稳定。通常5-10倍体积缓冲液即足够。这一步骤中请注意系统压力。若样品很粘稠,压力可能超过建议值(10bar)。可降低流速至0.5-1ml/min。若His融合蛋白未结合,可进一步降低流速。在蛋白洗脱步骤时可以加大流速。收集流出组分,以备SDS-PAGE电泳分析。
7. 以1×Ni-NTA漂洗缓冲液漂洗至A280至基线。通常5-10倍体积缓冲液即足够。收集流出组分用于SDS-PAGE电泳分析。
8. 以1×Ni-NTA洗脱缓冲液洗脱目的蛋白。
9. 根据需要可采用梯度洗脱。每个洗脱梯度(咪唑浓度梯度可以通过将洗脱缓冲液与漂洗缓冲液按一定体积比例混合获得)通常5-10倍体积缓冲液即足够。His·Tag融合蛋白一般在第二、第三个柱体积时洗脱下来。
(三)批次小量纯化
1. 取1ml菌液,加入一个小离心管中。需要破碎多少菌体依赖于目的蛋白的表达水平。若蛋白高水平表达,1ml菌液所含目的蛋白就足够了(参考表1)。若蛋白表达水平低,可能需要更大体积的菌液。若需要检测诱导培养时间对蛋白表达水平的影响,每隔30min从培养体系中取出1ml菌液,离心收集菌体,-20℃保存,直至所有样品收集完全。
2. 15,000g离心1min,收集菌体,弃上清。若需要更大体积的菌液,可向离心后去除上清的离心管中再加入菌液,再次离心,从而获得更多菌体。
3. 将细胞沉淀在-20℃冷冻15-20min。
4. 将细胞完全解冻,用100μl 1×Ni-NTA结合缓冲液重悬菌体。若仅取1ml菌液,浓缩系数为10,对于某些需要在天然条件下纯化的蛋白来说可能不够,请参考表1 。
5. 加入溶菌酶4.5-6KU 30℃孵育15min。
6. 轻柔涡旋,裂解细胞,避免起泡。
可选做:每100μl重悬细胞加入2.5u Benzonase核酸酶。可将Benzonase稀释10倍(2.5U/μl)以方便取用(稀释缓冲液请垂询)。
7. 裂解物15,000g离心10min。除去细胞不溶残片,上清转入干净小管中。
8. 每管加入20μl 50% Ni –NTA His·Bind 树脂悬液(相当于10μl树脂,可结合50-100μg His·Tag融合蛋白),4℃轻柔混匀,结合30min。
9. 15,000g离心10s沉淀树脂,取10μl上清转入另一干净小管中,以备电泳分析。弃去其它上清。上清留样保存于冰上。上清样品包含无法与树脂结合的蛋白。
10.用100μl 1×Ni-NTA漂洗缓冲液漂洗树脂2次。每次漂洗步骤包括15,000g离心10秒,小心吸去上清。
11.用20μl 1×Ni-NTA洗脱缓冲液洗脱目的蛋白3次。每次洗脱步骤包括15,000g离心10秒,小心将上清转移至干净小管中。
12.SDS-PAGE分析第8步(未结合组分)和第10步洗脱组分。
B.变性条件的纯化
(一)柱层析
1、 将1ml 50% Ni-NTA His·Bind树脂悬液加到4ml细胞裂解液中,轻柔混匀(如旋转混合器200rpm),室温结合15-60min。
2、 将裂解液与Ni-NTA His·Bind 树脂的混合物小心加入下端封闭的空色谱柱中。
3、 除去柱下端封闭盖子,收集流出液(穿过峰),保存用于SDS- PAGE电泳分析。
4、 以 4ml buffer C 漂洗杂蛋白2次。保存漂洗组分用于SDS- PAGE电泳分析。
5、 以 0.5ml buffer D洗脱目的蛋白4次,再以0.5ml buffer E洗4次,收集组分,用SDS-PAGE分析。蛋白单体通常用buffer D 即可洗脱,而多聚体、聚合物和含两个His·Tag 标签的蛋白通常由buffer E洗脱。
表1:确定所需菌液体积
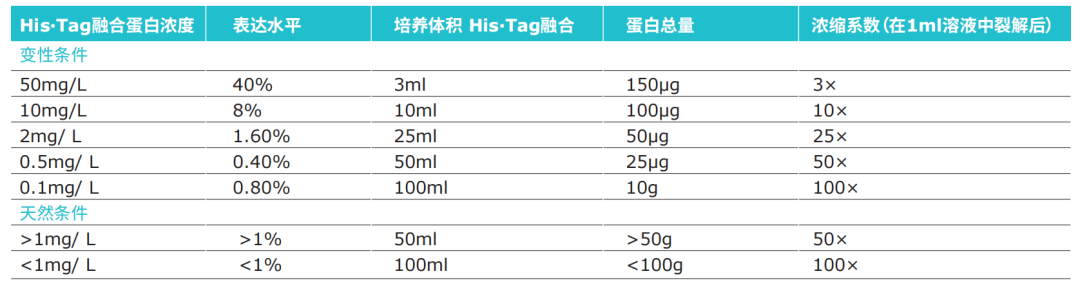
与其它亲和纯化介质一样,His·Bind树脂在接近其结合载量时使用,可以获得最好蛋白分离效果。所以在蛋白纯化前估计细菌抽提物中目的蛋白的含量,有利于确定上样量、选择合适体积的亲和树脂或预装柱。SDS-PAGE,Western blot,S·TagTM,Rapid Assay,FRETWorksTM S·Tag Assay 等方法都可用于确定抽提物中目的蛋白的含量。
(二)FPLC纯化
若需纯化大量蛋白,可以使用FPLC 设备,需配合Ni-NTA His·Bind Superflow 柱(货号70691)使用。Ni-NTA His·Bind Superflow 的物理稳定性使其适用于较高压力和流速的层析方式。
1、 按 FPLC设备的安装要求,装好色谱柱。去除色谱柱的上端接头并将柱下端封闭。
2、 彻底重悬一定体积50% Ni-NTA His·Bind Superflow树脂悬液,倒入空柱中。
3、可超使树脂沉降。通过打开柱下方盖子,使缓冲液流动,可以加快树脂沉降过程。也可根据具体需要使用蠕动泵,但流速不过2ml/min。
4、 加入上端接头,调整至沉降树脂上端。避免引入任何气泡。装好的色谱柱可以接入FPLC系统流路中。
5、 以5倍床体积buffer B平衡色谱柱。280nm紫外监控,当用5倍床体积缓冲液平衡后,基线应稳定。
6、 上样,以buffer B洗至A280 低于0.01,通常5-10倍体积缓冲液即足够。开始时控制流速在1ml/min。
7、 以buffer C漂洗至A280 小于0.01 。通常5-10倍体积缓冲液即足够。Buffer C洗脱与树脂非特异性结合的组分,收集流出组分用于SDS-PAGE电泳分析。
8、 以buffer D或buffer E洗脱目的蛋白。若使用buffer D无法完全洗脱目的蛋白,可以使用buffer E。
(三)批次小量纯化
1、取1ml菌液加入一个小离心管中。需要破碎多少菌体依赖于目的蛋白的表达水平。若蛋白高水平表达,1ml菌液所含目的蛋白就足够了(参考表4)。若蛋白表达水平低,可能需要更大体积的菌液。若需要检测诱导培养时间对蛋白表达水平的影响,每隔30min从培养体系中取出1ml菌液,离心收集菌体,-20℃保存,直至所有样品收集完全。
2、15,000g离心1min,收集菌体,弃上清。若需要更大体积的菌液,可向离心后去除上清的离心管中再加入菌液,再次离心,从而获得更多菌体。
3、以200μl Buffer B重悬菌体。轻柔涡旋裂解细胞,避免起泡。裂解完全后,溶液变为半透明状态。多数蛋白在Buffer B中可溶。若溶液无法变透明,以buffer A裂解细胞。
4、15,000g离心10min,除去细胞不溶残片,上清转入干净小管中。
5、每管加入50μl 50% Ni-NTA His·Bind 树脂悬液(相当于25μl树脂,可结合125-250μg His·Tag®融合蛋白),轻柔混匀,室温结合30min。
6、15,000g离心10s沉淀树脂,取10μl上清转入另一干净小管中,以备电泳分析,弃去其它上清。上清留样保存于冰上。上清样品包含无法与树脂结合的蛋白。
7、以250μl buffer C漂洗树脂2次。每次漂洗步骤包括15,000g离心10s,小心吸去上清。
8、以25μl buffer E洗脱目的蛋白3次。每次洗脱步骤包括15,000g 离心10s,小心将上清转移至干净小管中。
9、SDS-PAGE电泳分析各组分。若使用buffer A裂解菌体,含盐酸胍的样品需要事先处理方能用于SDS-PAGE电泳上样。
第三部分:树脂再生
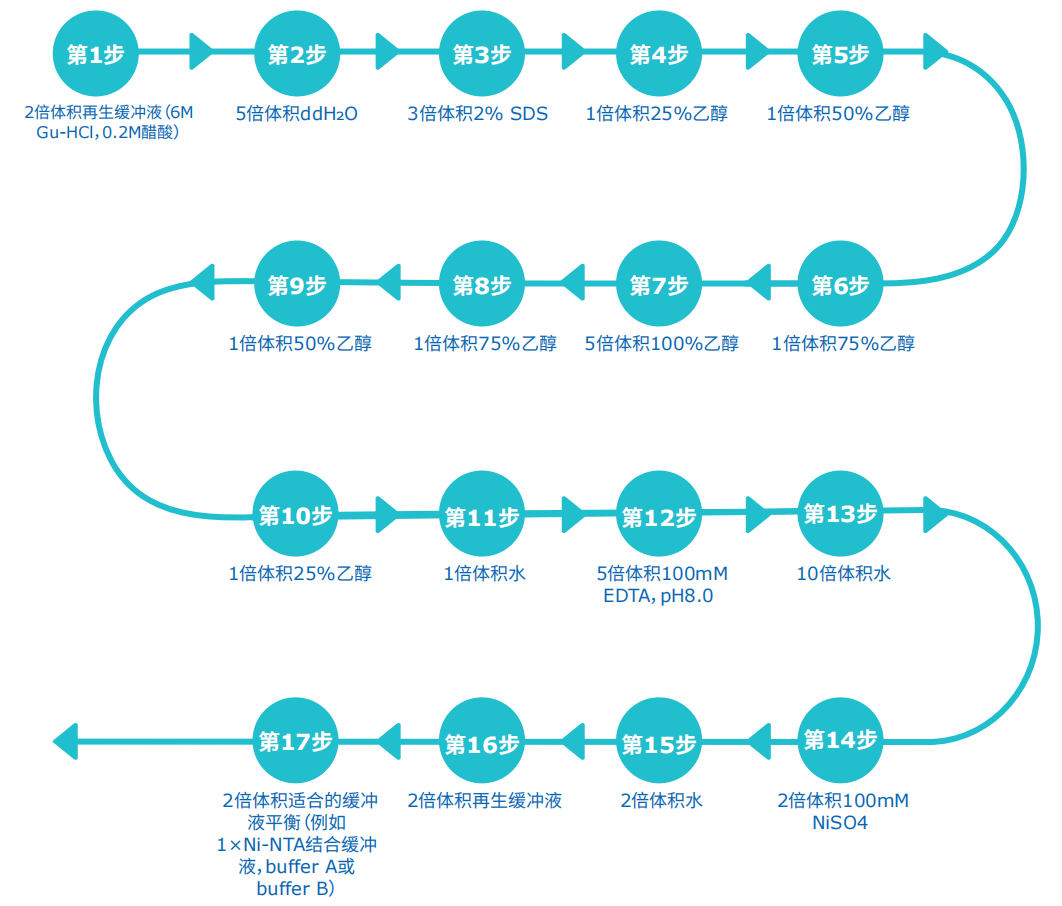
Ni-NTA His•Bind树脂能否反复使用主要取决于样品的特性,只能在纯化同一种重组蛋白是树脂才可以反复使用。建议树脂再生不超过5次。如果Ni-NTA树脂由浅蓝色变为棕灰色就应该采用以下方法对树脂进行再生处理了。
默克生命科学提供丰富的His纯化产品
类型 | 产品描述 | 特点 | 包装 | 目录号 |
NTA | Ni-NTA His·Bind® Resin | 预包被Ni2+即用型NTA树脂,载量5-10mg/mL,载量和包装规格适合实验室常见His纯化需求。可重复使用并可再生重复使用5次,配套缓冲液试剂盒目录号70899(包括4×浓缩的结合/漂洗/洗脱缓冲液);从大肠杆菌裂解到纯化的完整试剂盒目录号为70751 | 10mL,25mL, 100mL | 70666 |
HIS-Select® Nickel Affinity Gel | 载量15mg/mL,最大流速150cm/hr,可以再生重复使用 | 5mL,25mL, 100mL, 500mL | P6611 | |
高载量、高流速 | cOmplete™ His-Tag Purification Resin | 预包被Ni2+即用型树脂,特殊工艺改良可兼容EDTA和DTT,并使毒性Ni2+ 渗漏最低。载量高达≥40mg/mL,最大流速1420cm/hr,可以重复使用5次,200mL大包装目录号为5893801001 | 25mL | 5893682001 |
Ni-NTA His·Bind®Superflow™ Resin | NTA树脂,载量50mg/mL,适合FPLC纯化,可以再生重复使用5次 | 10mL,25mL, 100mL | 70691 | |
HIS-Select® HF Nickel Affinity Gel | NTA树脂,载量15mg/mL,最大流速3,000cm/hr,用于FPLC纯化,可以再生重复使用 | 1mL,10mL, 25mL,100mL, 500mL | H0537 | |
IDA | His·Bind® Purification Kit | 试剂盒内提供10mL IDA树脂(目录号69670)、整套缓冲液(目录号69755,含螯合/结合/漂洗/洗脱/剥离缓冲液)和色谱柱,用于按需灵活自行装柱 | 10mL | 70239 |
His·Bind® Resin HIS-Select® Nickel | 载量8mg/mL,可以再生使用数百次,非常灵活经济 | 10mL,50mL, 100mL | 69670 | |
磁珠 | HIS-Select® Nickel Magnetic Agarose Beads | 载量≥15mg/mL,用于小量自动化His融合蛋白纯化 | 1mL, 5mL | H9914 |
PureProteome™ Nickel Magnetic Bead System | 载量5mg/mL,用于His融合蛋白高通量纯化和免疫沉淀,目录号LSKMAGH10为10mL包装 | 2×1mL | LSKMAGH02 | |
离心柱 | HIS-Select® Spin Columns | 离心或真空抽滤方式,操作方便,可多样本同时纯化,载量150µg/柱 | 10个,50个 | H7787 |
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味