【Merck】Magna RIP™ RNA结合蛋白免疫沉淀试剂盒
在复杂的细胞过程(如发育、分化、对环境变化的细胞反应)中,基因调节起着至关重要的作用。除转录因子参与的基因表达转录调控外,细胞还应用转录后调节机制。在此机制中,涉及到某些RNA结合蛋白(RBP),共同瞬时调控功能性相关基因产物的mRNA的翻译速度。尽管转录因子调控基因表达已经被广泛的研究,RBP介导的对mRNA的转录后调控以及在此过程中非编码RNA所起的作用尚未阐明。广泛应用的ChIP(染色质免疫沉淀)试验,能够在体内细胞环境中识别DNA结合蛋白的DNA靶标。与之类似,RNA结合蛋白免疫沉淀(RIP)可可用于识别与特定细胞核或细胞浆结合蛋白相关的特定RNA分子(包括多种类型)。这些实验涉及RNA结合蛋白的内源性复合物的免疫沉淀,以及与此RNA结合蛋白有关的任何RNA种类的共同分离。这些种类RNA的纯化使得mRNA(和与之有关的潜在的非编码RNA)的分离和识别成为可能。RIP实验兼容下游应用,包括定量逆转录聚合酶链式反应(RT-PCR)、微阵列分析(RIP-芯片)和“深度测序”或者其他基于2代测序的平台(RIP-Seq)。Millipore通用RIP免疫沉淀试剂盒,允许研究人员利用针对RNA结合蛋白抗体或标签抗体进行RIP实验。此外,我们还以RIPAb+试剂盒形式提供RIP实验验证过的抗体,包括RIP实验验证所需的对照 (请参见www.merckmillipore.com)。
Magna RIP™和EZ-Magna RIP™组分盒
Magna RIP(目录号17-700) | EZ-Magna RIP(目录号17-701) | Magna RIP Quad(目录号17-704) |
MAGNARIP01(4℃下贮藏) | MAGNARIP01(4℃下贮藏) | MAGNARIP01(数量4)(4℃下贮藏) |
MAGNARIP02(-20℃下贮藏) | MAGNARIP02(-20℃下贮藏) | MAGNARIP02(数量4)(-20℃下贮藏) |
- | MAGNARIP03(-20℃下贮藏) | - |
试剂盒组分
A.所提供的试剂盒组分
本试剂盒提供两个盒子,含有进行22次独立染色质免疫沉淀(ChIP)反应的所有必需试剂。收到后,请在所示温度下储存。所提供的缓冲液足以用于五个15cm细胞培养皿中获得的染色质,每个平皿可提供10份染色质溶液(随细胞类型和分析类型而变化)。
MAGNARIP01(所有RIP试剂盒包含的组分盒)(4℃下贮藏) | ||
组分 | 目录号 | 数量 |
A/G混合磁珠 | CS203178 | 0.66mL |
RIP洗涤缓冲液 | CS203177 | 100mL |
RIP裂解缓冲液 | CS203176 | 2.4mL |
0.5M EDTA | CS203175 | 0.5mL |
10% SDS | CS203174 | 0.3mL |
盐溶液 | CS203173 | 1.0mL |
盐溶液 I II | CS203185 | 0.3mL |
MAGNARIP02(所有RIP试剂盒包含的组分盒)(-20℃下贮藏) | ||
沉淀促进剂 | CS203208 | 0.1mL |
正常小鼠IgG | CS200621 | 125ug |
纯化兔IgG | PP64B | 125ug |
蛋白酶抑制剂混合物200X | CS203220 | 20uL |
核糖核酸酶抑制剂 | CS203219 | 75uL |
蛋白酶K (10mg/mL) | CS203218 | 0.36mL |
不含核酸酶的水 | CS203217 | 0.3mL |
MAGNARIP03(仅17-701的组分盒)(-20℃下贮藏) | ||
阳性对照抗体(抗SNRNP70)** | CS203216 | 23μL (0.5μg/ μL),足以进行两次免疫沉淀 |
RIP引物,U1 snRNA**For(正向引物):5’-GGG AGA TAC CAT GAT CAC GAA GGT-3’REV(反向引物):5’-CCA CAA ATT ATG CAG TCG AGT TTC CC-3’ | CS203215 | 75μL(对人类U1 snRNA具有特异性的每种对照引物5μM) |
注意:试剂盒包括足够操作12次免疫沉淀的试剂量。
根据免疫原序列相似性预测,抗SNRNP70兔多克隆抗体能与人、小鼠、大鼠和犬类SNRNP70发生交叉反应。U1 snRNA RIP引物也应能够扩增这些物种中U1 snRNA转化的cDNA。
贮藏
收到后,各组分请在标签所示温度下贮藏。
若按指示贮藏时,试剂盒组分自运送日期起可稳定贮藏6个月。
B.未提供的试验材料
试剂
●用于RNA结合蛋白免疫沉淀(RIP)的目的抗体
●PBS(不含核糖核酸酶)(如Fisher,目录号BP2438-4)
●苯酚:氯仿:异戊醇(125:24:1 pH = 4.3) (如Fisher,目录号BP1754I)
●氯仿(如Fisher,目录号BP1145)
●100%乙醇(分子生物学级)
关于标准终点RT-PCR
●cDNA 合成试剂盒或逆转录酶( 如ABI,目录号PN 4387406)
●用于标准PCR的Taq DNA聚合酶和缓冲液
●dNTPs,各2.5mM
关于qRT-PCR
●cDNA合成试剂盒或逆转录酶( 如ABI,目录号PN 4387406)
用于qPCR的SYBR Green主混合物(如ABI,目录号PN 4367659)
设备
●磁力架(MerckMillipore,目录号20-400)
●真空抽吸器
●涡旋振荡器
●旋转混合仪
●细胞培养物离心机
●微量离心机
●超低温冷冻柜(<-80℃)
●热混合仪(能达到55℃)
●可变温度水浴或培养箱
●旋转器
●计时器
●移液管(2mL,5mL,10mL,25mL)
●不同容量(5-1000μL)移液管
●不含核酸酶的过滤器移液管吸头
●细胞刮捧
●离心管(15mL和50mL)
●不含核酸酶的微量离心管,1.5mL
●热循环仪(终点或实时)
●PCR离心管,0.2mL
C.危害信息
本方案采用苯酚等有机物萃取。与苯酚接触会引起灼伤,可能致死。操作苯酚时,应佩戴手套使用其它个人防护设备。
含有二甲亚砜(DMSO)的200X蛋白酶抑制剂混合物接触时,可能渗透皮肤和粘膜。操作蛋白酶抑制剂混合物时,应佩戴手套使用其它个人防护设备。
RIP工作流程
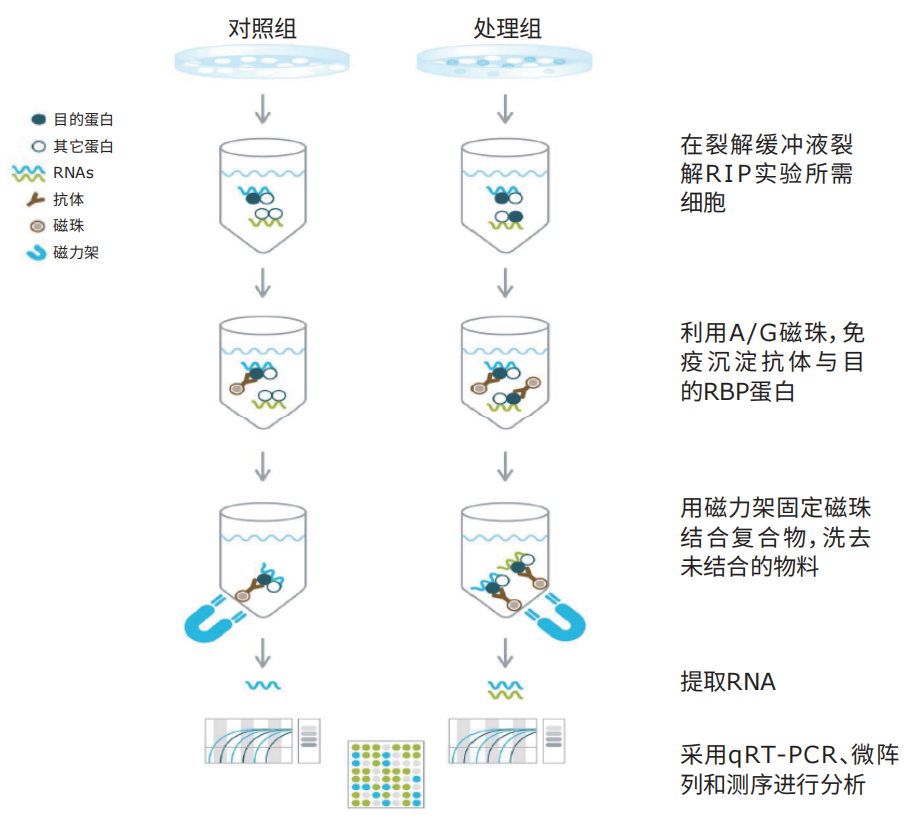
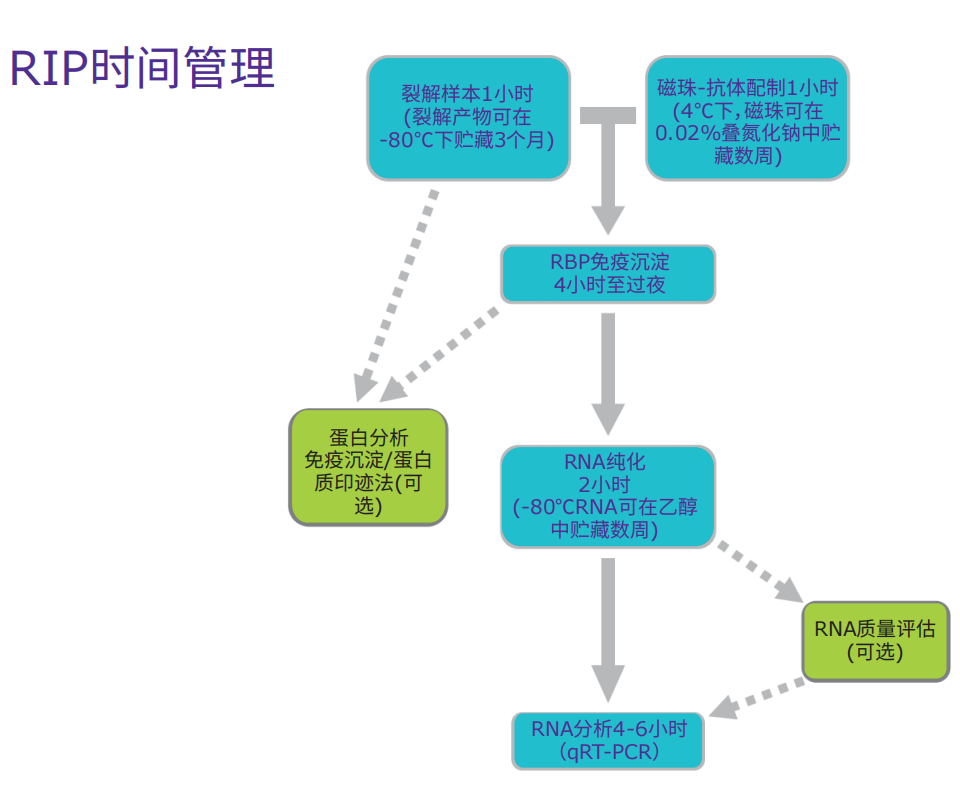
RNA结合蛋白免疫沉淀实验步骤
RIP实验的裂解物要求
计算免疫沉淀次数。所需样品包括目的抗体(用户提供),与目的抗体同类物种的阴性对照IgG。RIP常用对照品,anti-SNRNP70(目录号CS203216)和阴性对照品正常兔IgG(目录号PP64B)均包含在EZ-Magna RIP试剂盒(目录号17-701)中。
浓缩的细胞裂解物对于成功的免疫沉淀非常重要。通常情况下,一次RIP反应(即使用一种抗体进行的一次免疫沉淀)需要100μL 2.0x107细胞的裂解产物)或者一个15cm培养板。根据所得细胞沉淀的体积,决定RIP实验需要的裂解缓冲液体积。裂解缓冲液体积可能会根据所使用的细胞类型不同而变化。表1为您列出HeLa细胞培养物体积和所需RIP裂解缓冲液的一个示例。一旦您在特定细胞环境中应用候选抗体获得成功的RIP试验,您可以在必要时减少或进一步优化每次RIP试验的裂解产物用量。
每次RIP所用的细胞总数或蛋白总量,必须依据所研究的RNA结合蛋白的丰度以及下游RNA检测方法进行优化。
表1,每细胞培养物容器(HeLa细胞)的RIP裂解缓冲液的近似体积
容器类型 | 表面积 (cm2) | 细胞数 | RIP裂解缓冲液的体积(μL) |
T-75 | 75 | ~1.0 x 107 | 50 |
T-225 | 225 | ~3.0 x 107 | 150 |
10-cm平板 | 78.5 | ~1.0 x 107 | 50 |
15-cm平板 | 176.6 | ~2.3 x 107 | 115 |
控制核酸酶污染
在本实验整个流程中,应尽量采取标准预防措施,以减少核糖核酸酶的污染。为最小程度的引入核糖核酸酶,应在所有操作时,佩戴上手套。根据RNA操作的标准方案,对接触细胞或细胞裂解产物的所有仪器、玻璃器皿和塑料器皿,应确保不含核糖核酸酶污染,或采用DEPC或其它核糖核酸酶灭活试剂进行预处理。本试剂盒已包含核糖核酸酶抑制剂(目录号CS203219)。使用非本试剂盒组分其他溶液,应确保不含脱氧核糖核酸酶或者核糖核酸酶。
A. 裂解产物的配制
●根据试验需要刺激或者处理细胞。在培养瓶或培养皿中培养的贴壁哺乳动物细胞,密度约80-90%为适宜。
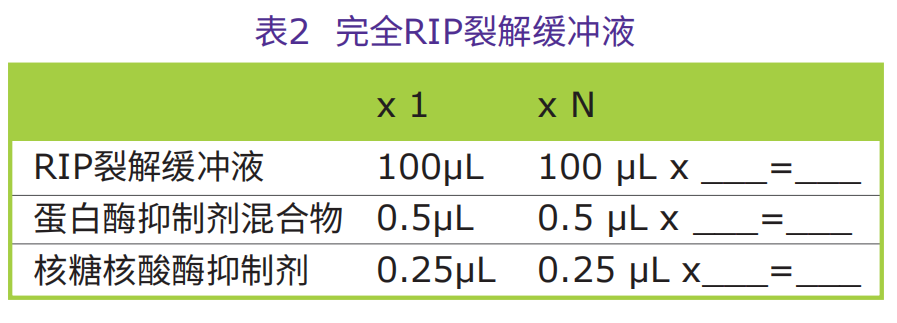
全RIP裂解缓冲液的配制
●根据所得细胞量,配制适量的全RIP裂解缓冲液(请参见表2)。
每100μL RIP裂解缓冲液,加入0.5μL蛋白酶抑制剂混合物和0.25μL核糖核酸酶抑制剂,置于冰上待用。
对于单层细胞或贴壁细胞:
1.用10mL预冷PBS,洗涤烧瓶或平板上的细胞两次。
2.加入10mL预冷PBS。从每个烧瓶或平板上刮下细胞,转移到一个离心管中。如需要,可采用血细胞计数器进行细胞计数。
3.在4℃下,1500rpm速度离心5分钟,弃去上清液,以收集细胞。
4.重悬将细胞沉淀重悬于与等体积的完全RIP裂解缓冲液中。用移液管吹打混合,直至细胞在混合液分散均匀。将裂解产物置于冰上孵育5分钟。此步低渗RIP缓冲液使细胞膨胀。每种裂解产物取约200μL,置于不含核酸酶的微量离心管中,贮藏于-80℃下。
通常,每种抗体对应的裂解产物体积一般是100µL/RIP,并且实验中常常包括阳性和阴性抗体,因此,单次分装200µL细胞裂解物是比较适合的。为避免多次冻融,建议将裂解产物按需分装贮藏。
对于悬浮细胞:
1.在一个15mL锥形管中收集细胞。采用血细胞计数器对细胞进行计数。
2.4℃下,1500rpm,离心5分钟,弃去上清液,收集细胞,。
3.在10mL预冷的PBS中重悬细胞并洗涤。4℃下,1500rpm,离心5分钟,弃去上清液,收集细胞。
4.重复第3步,再进行一次洗涤。
5.在等体积完全RIP裂解缓冲液中重悬细胞沉淀。移液管吹打混均。将裂解产物放置在冰上孵育
5分钟。每种裂解产物约取200μL,置于不含核酸酶的微量离心管中,贮藏于-80℃下。
通常,每种抗体对应的裂解产物体积一般是100µL/RIP,并且实验中常常包括阳性和阴性抗体,因此,单次分装200µL细胞裂解物是比较适合的。为避免多次冻融,建议将裂解产物按需分装贮藏。
对于组织样品:
1.将新切取的全组织用预冷的PBS洗涤三次。
2.使用杜恩斯匀浆器或其它细胞分离器械,在预冷的PBS中分离该组织,直至获得单细胞悬浮液。
3.4℃下, 1500rpm,离心5分钟,弃去上清液,收集细胞。
4.在等体积完全RIP裂解缓冲液中重悬细胞团块的。移液管吹打混均。将裂解产物放置在冰上孵育5分钟。每种裂解产物约取200μL,置于不含核酸酶的微量离心管中,贮藏于-80℃下。
通常,每种抗体对应的裂解产物体积一般是100µL/RIP,并且实验中常常包括阳性和阴性抗体,因此,单次分装200µL细胞裂解物是比较适合的。为避免多次冻融,建议将裂解产物按需分装贮藏。
重悬注意
本方法只冻融一次,以便温和地裂解细胞。
裂解产物的即时初次冷冻,对完全裂解至关重要。
裂解产物可在-80℃下贮藏3个月。
避免多余的细胞冻融,以防止蛋白和RNA降解。
新鲜分离的细胞,对RIP实验的成功至关重要。
B. 用于免疫沉淀的磁珠配制
RIP实验的成功取决于高质量抗体的使用。用于免疫沉淀的抗体用量,取决于其用于免疫沉淀时候选择抗体的形式(如纯化或非纯化)和有效亲和力。如使用纯化抗体,建议每次免疫沉淀使用5µg作为参考,如若使用非Merck Millipore RIPAb+验证抗体,则需要优化抗体的使用。
建议使用磁力架方便磁珠洗涤操作。为避免引入核糖核酸酶,如有可能,请使用无核糖核酸酶的无菌微量移液枪头。
1.通过颠倒微量离心管或移液管吹打,重悬磁珠至完全分散均匀重悬。
2.标记用于免疫沉淀实验的适当数量微量离心管。
样品包括目的抗体(用户自备),以及与目的抗体同一物种的阴性对照抗体。
当使用EZ-Magna RIP(目录号17-701)时,anti-SNRNP70(目录号CS203216)和阴性对照正常家兔IgG(目录号PP64B)可用作RIP分析的对照品。
3.量取50µL磁珠悬浮液,转移到每个离心管中。
4.在每个离心管中加入0.5mL RIP洗涤缓冲液,短暂涡旋。
5 .离心管磁力架把离心管置于磁力架(如Merck Millipore,目录号
20-400)上,磁珠被磁力架吸附在管壁后,弃去上清液。
6.从磁力架中取出离心管。在每个离心管中加入0.5mL RIP洗涤缓冲液,短暂涡旋。
7. 把离心管放在磁力架中,弃去上清液。
8. 从磁力架中取出离心管,使磁珠重悬于100µL RIP洗涤缓冲液中。在离心管中加入约5µg目的抗体。
9. 室温下,旋转培养30分钟。
10.离心管短暂离心,放在磁力架中,除去上清液。
11.从磁力架中取出离心管。在每个离心管中加入0.5mL RIP洗涤缓冲液,短暂涡旋。
12.把离心管放在磁力架中,弃去上清液。
13.重复第11-12步,再进行一次洗涤。
14.从磁力架中取出离心管。在每个离心管中加入0.5mL RIP洗涤缓冲液,短暂涡旋。把离心管置于冰上备用。
C. RNA结合蛋白-RNA复合物免疫共沉淀(RIP)
1.配制RIP免疫沉淀缓冲液。每次免疫沉淀实验需要900μLRIP免疫沉淀缓冲液。每一次反应,在860µL RIP洗涤缓冲液中加入35μL0.5M EDTA和5µL核糖核酸酶抑制剂(如表3)。

2.把第II节第14步所得离心管放在磁力架中,弃去上清液。在每个离心管中加入900µL RIP免疫沉淀缓冲液。
3.快速解冻第I节中所得RIP裂解产物,4℃下,14,000rpm,离心10分钟。取100µL上清液加至含有磁珠-抗体复合物的RIP免疫沉淀缓冲液中。免疫沉淀反应的最终体积将为1.0mL。
4.取RIP裂解产物的上清液10µL,置于一个新的离心管中,标记为“input”。把这份input样品贮藏在-80℃,直至RNA纯化操作(第IV节)。这份“10%input”的“input”将会用于绘制标准曲线或用于RT-PCR方法(实时或终点)的比较。这份input RNA样品也可用于RNA质量评估(第V节, 可选)。
(可选)取RIP裂解产物的10µL上清液,采用蛋白质印迹法检测RNA结合蛋白的表达。在10µL RIP裂解产物中加入10µL 2x SDS-PAGE上样缓冲液, 并在95℃下加热。RIP裂解产物可以直接应用于SDS-PAGE。
5.将所有离心管放置在旋转器上, 4℃下,孵育3小时至过夜。
6.短暂离心免疫沉淀反应离心管,放在磁力架中,弃去上清液。
7.从磁力架中取出离心管。在每个离心管中加入0.5mL RIP洗涤缓冲液,短暂涡旋。
8.把离心管放在磁力架中,弃去上清液。
9.重复五次第7步至第8步操作,用500µL预冷的RIP洗涤缓冲液洗涤磁珠六次。
(可选)在最后一次洗涤过程中,从500µL磁珠悬浮液中各取50µL,采用蛋白质印迹法检测免疫沉淀效率。使磁珠重悬于1X SDS-PAGE上样缓冲液中,并于95℃下加热,以洗脱磁珠上结合的蛋白。离心沉淀磁珠,上清液可直接用于SDS-PAGE检测。
D RNA的纯化
1.配制蛋白酶K缓冲液。每次免疫沉淀需要150µL蛋白酶K缓冲液。此缓冲液含有117µL RIP洗涤缓冲液、15µL 10% SDS和18µL 10mg/mL蛋白酶K可通过加入浓SDS,减少蛋白酶K变性的风险。
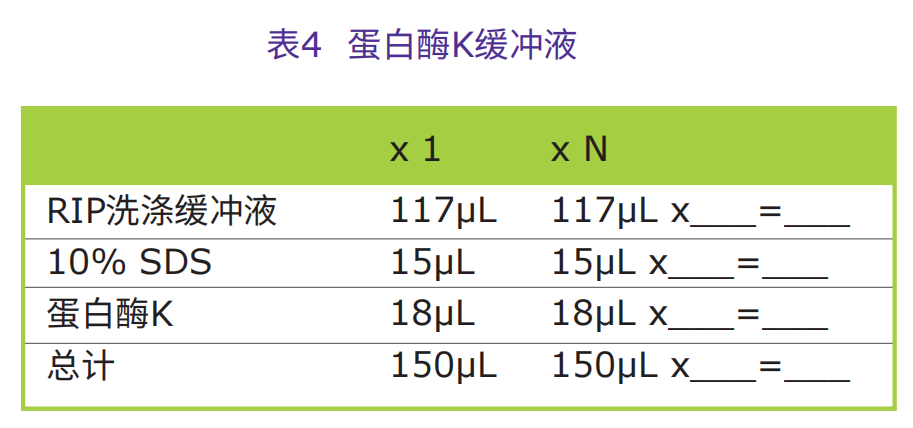
2. 重悬第III节第9步免疫沉淀物于150µL蛋白酶K缓冲液中。
3. 解冻第III节第4步所得的input样品, 在离心管中加入107µL RIP洗涤缓冲液、 15µL 10% SDS和18µL蛋白酶K,定容至总体积150µL。
4. 使所有离心管置于55℃下孵育30分钟,同时振荡以充分消化蛋白。
5. 孵育后,短暂离心离心管,把离心管放在磁力架上。把上清液转移到一个新的离心管中。
6. 在装有上清液的离心管中,加入250µL RIP洗涤缓冲液。
注意:在下面的第7步和第8步中,确保在涡旋之前盖紧离心管的盖子。
7. 在每个离心管中加入400µL苯酚:氯仿:异戊醇。涡旋15秒,在室温下,14000rpm,离心10分
8. 小心取出350μL水相,放在一个新的离心管中。加入400µL氯仿,涡旋15秒,在室温下,14000rpm,离心10分钟,以分离各相。
9. 小心取出300μL水相,放在一个新离心管中。
10.在每个离心管中,加入50µL盐溶液I、15µL盐溶液II、5µL沉淀增强剂,然后加入850µL无水乙醇。混匀,在-80℃下保存1小时至过夜,以沉淀RNA。
11.4℃下, 14,000rpm,离心30分钟,小心弃去上清液。
12.用80%乙醇洗涤沉淀一次。4℃下,14,000rpm,离心15分钟。小心弃去上清液,使沉淀自然风干。
13.重悬RNA沉淀于不含核糖核酸酶的10-20µL水中,将离心管置于冰上备用。
E.Input RNA的质量评估(可选)
1.NanoDrop®
通常情况下,可以采用NanoDrop分光光度计测定总RNA(或“input”)的吸光度。理想情况下, A260/A280比值将接近于2.0,表明RNA较纯且不含蛋白或化学品污染。如果这一比值小于1.8,那么可能影响其下游应用。由于免疫沉淀物中的RNA含量一般较低,因此不推荐采用NanoDrop分光光度计测定样品,如若需要,可用于评估来自input样品的RNA质量。
2.Bioanalyzer或Experion™
可以使用Agilent Bioanalyzer 的纳米芯片或Bio-Rad’s Experion的RNA HighSense芯片,分析免疫沉淀的RNA亚组分的分子量分布曲线。相较于甲醛-琼脂糖凝胶,Bioanalyzer或Experion,是一种方便且更灵敏的替代方法。对于总RNA(或“input”),评价18s/28s rRNA比值是非常有用的。介于1.6-2.0范围内的比值表明RNA具有良好的完整性。但是对免疫沉淀物质,此比值可能无法获得,除非已知rRNA是所研究免疫沉淀RNA结合蛋白的靶标。如此,免疫沉淀RNA的生物分析仪图谱仅用于检验RNA是否有严重的降解。
F. 免疫沉淀RNA的分析
采用Magna RIP试剂盒分离的RNA,兼容多种下游分子分析方法,包括终点RT-PCR和定量RT-PCR,(如果已知RBP的结合靶标),或采用微阵列或深度测序法。鉴于已知序列的RNA靶标,可以设计基因特异性引物,验证靶标抗体免疫沉淀的RNA。RIP实验一旦成功,可采用一些方法对免疫沉淀物中的RNA的深度分析,例如comparative microarray hybridization of resulting cDNAs or by deep sequencing of molecularly adapted products of the RIP reaction(详情请参见Baroni, T.E.et al.(2008),Methods Mol Biol.419:93-108)。下面列出采用EZ-Magna RIP试剂盒(目录号17-701,anti-SNRNP70[目录号CS203216])中所供应对照抗体进行的RIP实验终点或实时定量测定的方法。
关于逆转录反应,EZ-Magna RIP试剂盒的用户可以使用市场上供应的使用六聚体随机引物的逆转录酶和试剂盒系统。因为成熟的U1 snRNA与U1剪接体SNRNP70蛋白共同沉淀不是聚腺苷酸化,所以不推荐寡d(T)引物。
第一链cDNA合成示例(如高容量RNA-to-cDNA试剂盒,ABI目录号4387406)
注意:在本节操作中,推荐使用无核糖核酸酶的耐气溶胶吸头,以尽量减少污染风险。
1.为待分析的样品,标记适当数量的0.2mL PCR离心管,置于冰上备用。
2.在PCR离心管中,加入9μL(至多2μg RNA)样品,并放回到冰上备用。
3.按照表5,向放置在冰上的每个PCR反应管,加入相应的试剂。
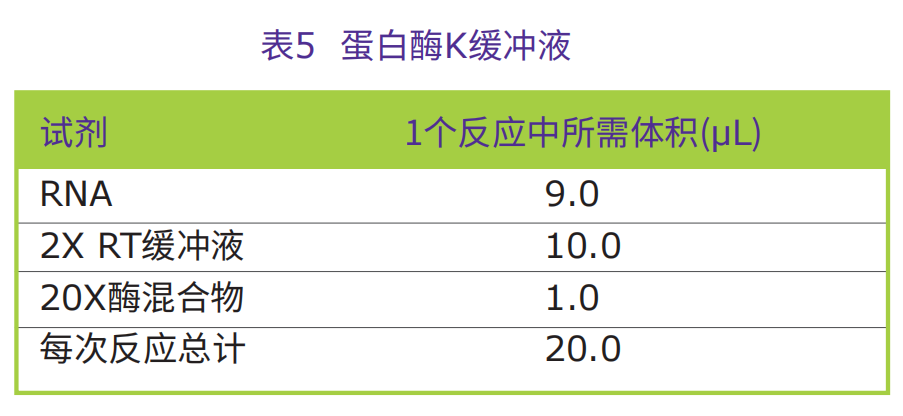
4.把PCR反应管放在PCR仪中。
5.启动下述RT反应程序:
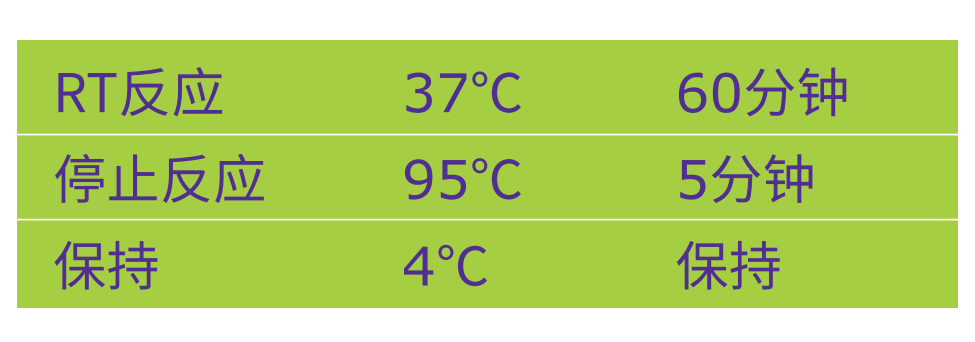
6.取出PCR离心管。用180μL不含核酸酶的水稀释反应物(10X稀释)。反应物可以在-20℃下贮藏。
标准终点RT-PCR
1.为待分析的样品,标记适当数量的0.2mL PCR离心管,并放在冰上保存。至少有4份样品采用本试剂盒包含的RIP引物进行PCR:从阳性对照抗体免疫沉淀中获得的cDNA、从阴性对照抗体免疫沉淀中获得的cDNA、input cDNA和DNA污染的对照“无模板” cDNA。
RIP引物对人类U1 snRNA基因具有特异性。如若cDNA来自其它物种,推荐用户设计适当的特异性引物,并根据经验确定相应的PCR反应条件。
2.在PCR离心管中,加入2μL适当的cDNA样品,并放回冰上保存。
3.如表6所示,在冰上的每个PCR反应管中,加入适量的试剂。首先加入H2O,最后加入Taq聚合酶。
推荐用户使用Hot-Start Taq聚合酶。若未使用Hot-Start Taq聚合酶,必须在初始变性后,在每个离心管中加入Taq酶。
如果配备主反应混合物,要以足够用于一个额外反应的试剂用量计算,以弥补在分装过程中的损失。
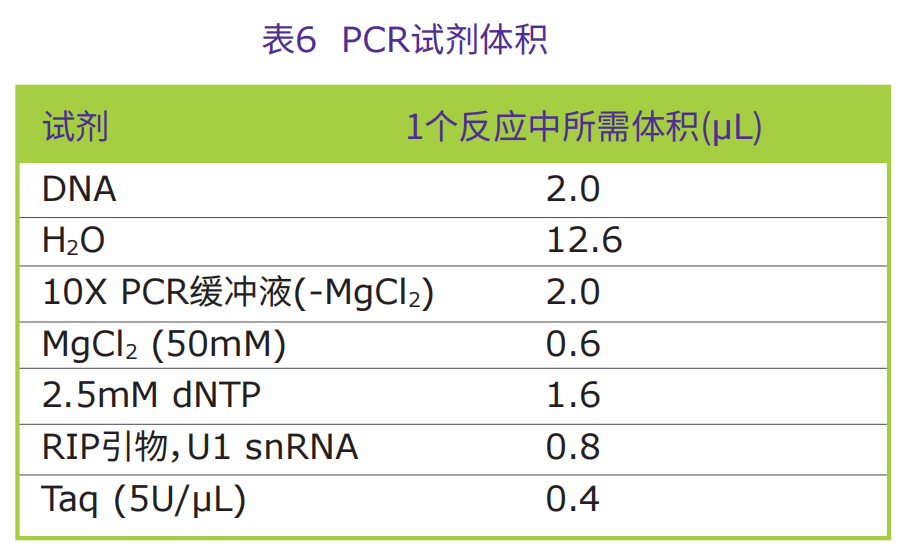
4.把PCR反应管放在PCR仪中。
5.启动下述PCR反应程序:
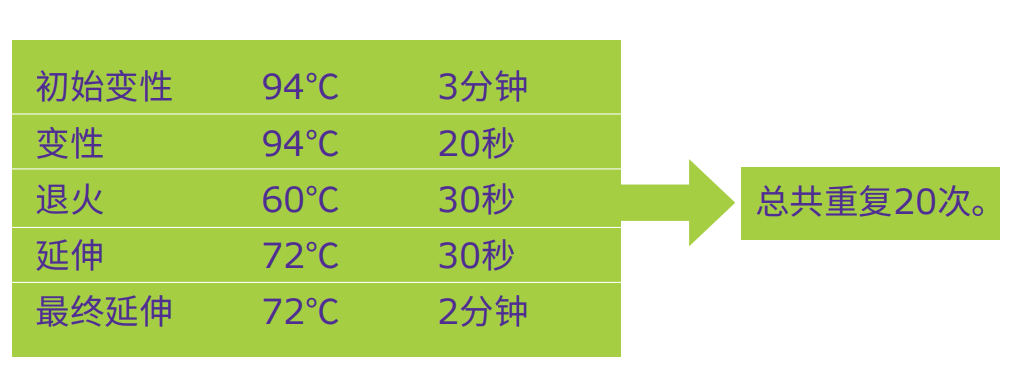
6.取出PCR管。反应物可以在-20℃下贮藏。
7.每种PCR反应物取10μL,用2%琼脂糖凝胶电泳进行分离,以100bp DNA Marker作为指示。
目录号17-701中包含的U1 snRNA的PCR产物大小预计是100个碱基对。请参见第12页图A。
实时定量PCR
1.在与您选用的实时定量PCR仪兼容的PCR板中,加入2μL cDNA样品(对每份ChIP样品,推
荐重复三次qPCR反应)。
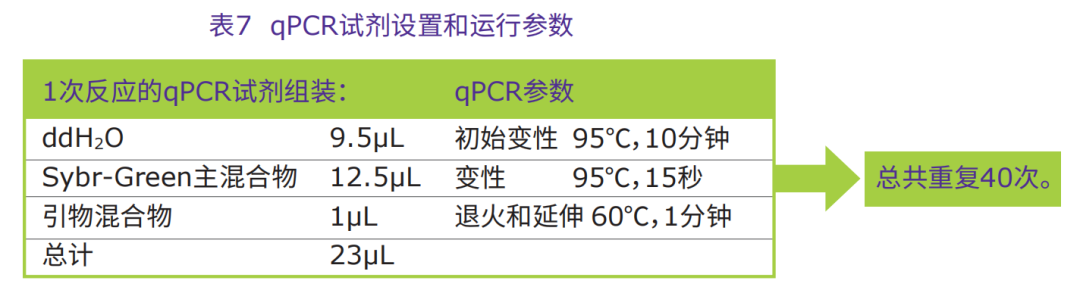
2.如表7所示,配制主反应混合物要以足够用于一个额外反应的试剂用量计算,以弥补在分装
过程中的损失。
3.在2μL样品中,加入23μL qPCR混合物。
4.使用盖子或光学胶带密封平板,启动qPCR反应
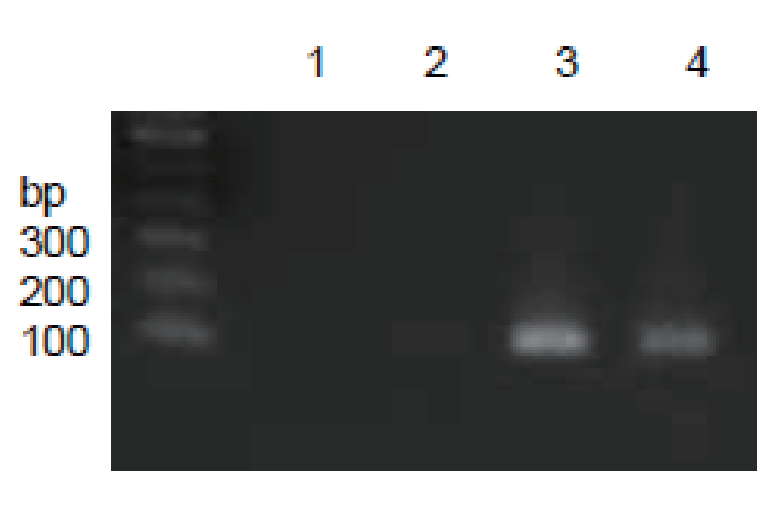
图A:RIP的PCR分析
该RIP实验以HeLa细胞裂解产物为样本,以anti-SNRNP70(目录号CS203216)或正常家兔IgG(目录号.# PP64B)作为免疫沉淀抗体。以纯化后的RNA为模板,以U1 snRNA(目录号CS203215)特异性RIP引物为引物,进行RT-PCR分析。泳道3可见明显的PCR产物,指示SNRNP70富集U1 snRNA。而泳道2中PCR产物很弱,指示负对照正常家兔IgG RIP未富集到U1 snRNA。U1 snRNA特异性cDNA也在10% input(泳道4)中观察到,但在“无模板”PCR对照品(泳道1)中没有观察到。
图B:RIP的PCR分析该
RIP实验以HeLa细胞裂解产物为样本,以anti-SNRNP70(目录号CS203216)或正常家兔IgG(目录号.PP64B)作为免疫沉淀抗体。以纯化后的RNA为模板,以U1 snRNA(目录号CS203215)特异性RIP引物为引物,进行qRT-PCR分析。

参考文献
1.Baroni, T.E., Chittur, S.V., George, A.D., Tenenbaum, S.A. (2008). Methods Mol Biol. 419:93-108.
2.Keene, J.D., Komisarow, J.M., Friedersdorf, M.B. (2006). Nat Protoc. 1(1):302-7.
3.Baroni, T.E., Lastro, M.T., Ranganathan, A.C., Tenenbaum, S.A., Conklin, D.S., Aguirre-Ghiso, J.A. (2007). Methods Mol Biol. 383:227-44.
4.Penalva, L.O., Tenenbaum, S.A., Keene, J.D. (2004). Methods Mol Biol. 257:125-34.
5.Tenenbaum, S.A., Lager, P.J., Carson, C.C., Keene, J.D. (2002). Methods. 26(2):191-8.
6.Tenenbaum, S.A., Carson, C.C., Lager, P.J., Keene, J.D. (2000). Proc Natl Acad Sci U S A. 19;97(26):14085-90.
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味