【Polysciences】PEI 转染试剂MW40,000使用说明(24765-1)
PEI 转染试剂
货号 |
产品名称 |
规格 |
24765-100 |
PEI 转染试剂 MW40,000 |
100mg |
24765-1 |
PEI 转染试剂 MW40,000 |
1G |
基本信息
CAS |
49553 - 93 - 7 |
分子式 |
(C2H5N)n.xHCl |
分子量 |
40,000 (~22,000 自由基) |
熔点 |
73 - 75℃ |
溶解性 |
溶于低温和室温水,不溶于常用有机溶剂(乙醇,丙酮,4 氢呋喃) |
形式 |
白色固体 |
安全防护 |
手套,护目镜,通风橱 |
保存 |
4 度避光干燥保存,配置好的工作液 4 度避光保存 |
运输 |
常温 |
PEI 工作液配置 (1 mg/mL)
1、称取 1g 24765-1溶于 900ml 去离子水中。
2、搅拌直至完全溶解。
3、加入 NaOH(1N)调整 PH 至 6.9-7.1。
4、如果 PH 超过 7.10,加入 HCL(1N)调整 pH 至 6.9-7.1。
5、将溶液转移至量杯或者量筒定容至 1L 。
6、用(0.2um)滤器真空过滤消毒,4°C 至少稳定保存 3 个月。
注意
●一定要溶解充分,溶解不充分会影响后续的转染效率。
操作方法
●特别提醒:初次使用 PEI 进行不同基因转染时应先做预试,优化出适合自己实验的最佳 PEI 和 DNA 的比例。
一、贴壁细胞转染
以 6 孔板转染 293T 细胞为例,大规模细胞转染可参考文献。
(一)转染前准备
1) 转染前一天:用胶原酶 (WORTHINGTONG 公司 LS004196)消 化细胞并计数(不建议用胰酶)。按照每孔2×10 6的细胞量接种293T 至 6 孔板(每孔加入 2ml 新鲜的 DMEM:F12+5%FBS 完全培养基和 1ml 的细胞悬液)置于 37°C,5%CO2培养 箱培养 24h。
2) 24h 后,移除之前培养基,每孔加入 2ml 新鲜的 DMEM:F12+5%FBS。注意:确保 293T 细胞生长状态良好传代 不超过 15 代。
(二)转染过程
3) 第一天:显微镜下检查细胞汇合度, 当细胞达到 70%到 80%的汇合度时,开始准备转染。
4) 对于每孔细胞,用 100µl 无血清培养基(如 OPTI-MEMⅠ培养基)稀释 DNA 使 DNA 终浓 度为 1ug/ml(DNA/总培养体积)。
5) 对于每孔细胞,用 100μL 无血清培养基(如 OPTI-MEMⅠ培养基)稀释适当比例的适量 24765-1。DNA:PEI 的比例要依据自己实验摸索最适比例。
6) 将稀释的 24765-1转染试剂加入到稀释的质粒中(总体积 200µL)轻轻混匀, 室温孵育 30 分钟。
7) 小心地将 PEI-DNA 复合物滴加到细胞培养板每个孔中,轻轻摇动培养板混匀。注意加 入混合液时轻轻沿着孔板边缘滴入,而不是在细胞的顶部以免破坏细胞的粘附性。
8) 将培养板放入 37°C,5%CO2培养箱培养中培养 24h。
(三)观察转染结果
9)第二天:在荧光显微镜下观察细胞转染效率,通常超过 80%的 293T 细胞在转染后的 24h可以观察到绿色荧光。
小贴士
●建议进行不同基因转染时应对 PEI 和 DNA 的比例进行优化,以达到最适比例,通常筛选范围在 1:1 到 5:1 之间。
●通常情况下,分别准备 PEI 和 DNA 转染溶液时其体积一般是转染前每孔细胞培养液体积总量的 1/10-1/20,如细胞培养液体积为 3ml,则稀释 PEI 及 DNA 的体积为 150ul。质粒 DNA 的浓度通常为 1ug/ml(DNA 质量/细胞培养总体积)。
●不同质粒种类以及大小会影响转染效率,如较大片段插入质粒可能转染效率低,可根据实际实验需要调整,如适当增加转染质粒总量等。
●HEK293 GnTI 细胞重悬浮可用枪头或移液管反复吹打,但 CHO-S 细胞的粘附性比较强重悬浮时需要借助细胞刮刀。
●一般建议用胶原酶消化细胞,如果表达的是膜蛋白,胰酶消化细胞可能会降低蛋白表达,建议用胶原酶消化细胞,我们推荐用(LS004196,WORTHINGTONG)的胶原酶。
●对于贴壁性低的细胞系,可用明胶或鼠尾胶铺板,增加细胞与培养皿之间的粘附性。
●一旦确定了细胞类型、培养基和 PEI 与 DNA 的最佳比例,就可以在转染后 24 至96 小时内多次观察转染效率,以优化最大表达量时间点。
二、悬浮细胞转染
离心对数期生长的细胞用新鲜的培养基重悬浮使细胞密度达到 1×106cells/mL 小规模转染时,如需大规模转染细胞密度要到达 2-3×106cellsml/mL,可参考文献[4]。以 293F 细胞于 100mL 培养瓶(溶液体积占瓶体积的 1/5)操作体系举例如下:
(一)转染前准备
1) HEK293F 细胞传代接种于 20mL 悬浮细胞生长培养基中(36.5℃,120rpm,5%CO2)的条件下培养。当细胞密度到 1X106cells/mL,然后旋紧瓶口放入摇床继续培养,2~4 小时后可以进行转染。
(二)转染过程
2)用 1mlOptiPRO™SFM(无血清培养基)稀释适量的 DNA,使 DNA 终浓度为 1ug/ml(DNA/总培养体积)。混匀并静置 5min。
3)用 1mlOptiPRO™SFM(无血清培养基)稀释适当比例的 PEI40000,混匀并静置 10min。(PEI:DNA 参考比例范围,可参考上述贴壁细胞 PEI 和 DNA 优化方案优化)。
4) 将 24765-1转染试剂加入到稀释的质粒中轻轻混匀,室温孵育 30 分钟。
5)将 PEI-DNA 转染复合物逐滴加入到细胞培养液中,摇匀后旋紧瓶口放回摇床(36.5℃,5%CO2,120rpm)。
6)基因表达可在 24-72 小时后检测,具体时间取决于细胞系和转基因。
小贴士
在悬浮培养中,单个细胞的转染效率要高于聚集在一起的细胞,需要优化适合单细胞的 生长条件。
方形瓶应经过两个连续的干燥循环高压灭菌(每个 45 分钟,干燥 15 分钟) 盖子应尽可能松,不得脱落。应该让它们冷却拧紧盖子前,将其完全放入层流罩中。如 果瓶子向内塌陷,细胞将无法正常生长。
如果要获得更多的蛋白产量,有参考文献表明转染后 24 小时,可以适当稀释细胞,稀释比例参考范围(1:2—1:5)之间,可以增加蛋白产量,稀释效应与最佳稀释比率应根 据经验确定[1][4]。
可以把 DNA 和 PEI 转染试剂直接加入到细胞悬液中进行转染,但必须经过上述 特定流程的 DNA 和转染试剂的比例和用量的相应优化。
背景
PEI 是一种优化的线性阳离子聚合物转染试剂分子量分别为 25000 和40000。40000 相 比 25000 转染效率高,但毒性也略大于 25000。在 HEK293和 CHO 的蛋白表达系统中,相 比于市面上的脂质体 PEI 都表现出高的蛋白表达量(无论是 96 孔板还是 100L 的细胞反应 器),以及更小的细胞毒性、更高的转染效和更高的可重复性,并且十分经济的高性价比 转染试剂。产品具有以下特点:
●转染效率高,细胞毒性低;
●蛋白表达量高;
●节约成本:PEI 至少能够降 40% 的转染试剂总成本;
●适用于 HEK293 等真核细胞的转染;
●适用于贴壁细胞和悬浮细胞的转染;
●适用于有血清和无血清的转染条件;
●无机试剂 ,无动物源成分;
●产品稳定,质控严格;
●工艺流程适用范围广,容易优化 适合小规模培养板,培养瓶到大规模的生物反应器。
24765-1(在游离碱中也称为 PEI22K)是一种功能强大,值得信赖且经济实惠 的瞬时转染试剂。在 HEK293 和 CHO 大多数表达系统中,PEI MAX 都能提供稳定的高表 达(96 孔板至 100L 生物反应器)。现在每年有更多的研究人员和公司选择使用 PEI MAX 进行细胞转染,因为相对于大多数转染试剂而言 PEI MAX 既能得到稳定的高表达又能 使转染成本降低最少 40%。
40000 比更 25000 易于使用,并且比 25K 有更高的转染效率, 通常 24765-1转染过程通常需要几个小时才能完成准备,而 24765-1可在两小时内完成整 个转染过程。另外,PEI25000 含有 4-11%的残留丙酰基,这可能阻碍聚合 物主链与 DNA 的有效结合,而 24765-1的丙酰基完全脱落,意味着 24765-1 每批产品的性能更加稳定。
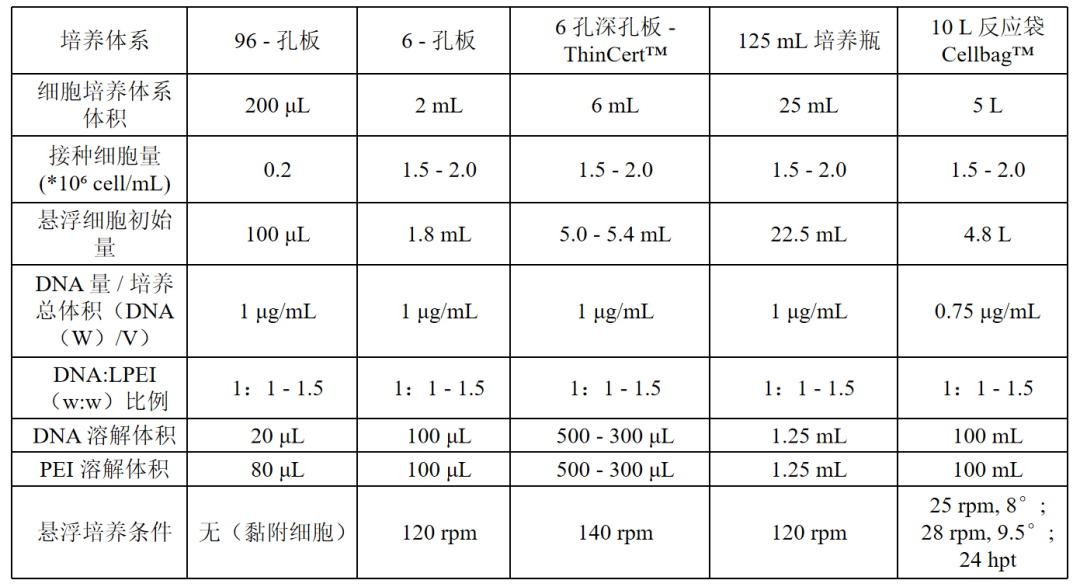
表 1 可借鉴的转染参数(96-孔板- 5L 生物反应袋[4])
常见问题

注意
本手册仅为 PEI 基本操作说明指导。基于 PEI 的转染效率受多种因素影响, 包括 PEI/DNA 复合物的制备方式、 PEI 与 DNA 的比例、DNA 浓度、 PEI 溶液的储存条件等。本手册不能覆盖 PEI 转染涉及的所有问题,只能根据主要影响因 素,如 PEI/DNA 比例 PEI 和 DNA 的浓度,孵育时间等提供相应的操作指南,以提高其 效率、重复性和一致性。如果我们提供的 PEI 手册无法回答您的问题,建议您查阅更 多参考资料,调整转染条件,为自己的实验找到合适的转染方法。
REFERENCES
1 Patti A. Longo, Jennifer M. Kavran, Min-Sung Kim, and Daniel J. Leahy: Transient Mammalian Cell Transfection with Polyethylenimine (PEI).Methods Enzymol. 2013 ; 529: 227–240.2
2 Shaozhe Yang,Xiaoling Zhou,Rongxiang Li, Xiuhong Fu, and Pingnan Sun: Optimized PEI-based Transfection Method for Transient Transfection and Lentiviral Production. Current Protocols in Chemical Biology 9:147–157, September 2017.
3 Yves Durocher,Sylvie Perret and Amine Kamen: High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1cells. Nucleic Acids Research,2002,vol.30,No.2.
4 Céline Raymond,Roseanne Tom ,Sylvie Perret ,Pascal Moussouami, Denis L’Abbé,Gilles St-Laurent ,Yves Durocher: A simplifified polyethylenimine-mediated transfection process for large-scale and high-throughput applications.Methods 55 (2011) 44–51.
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味









