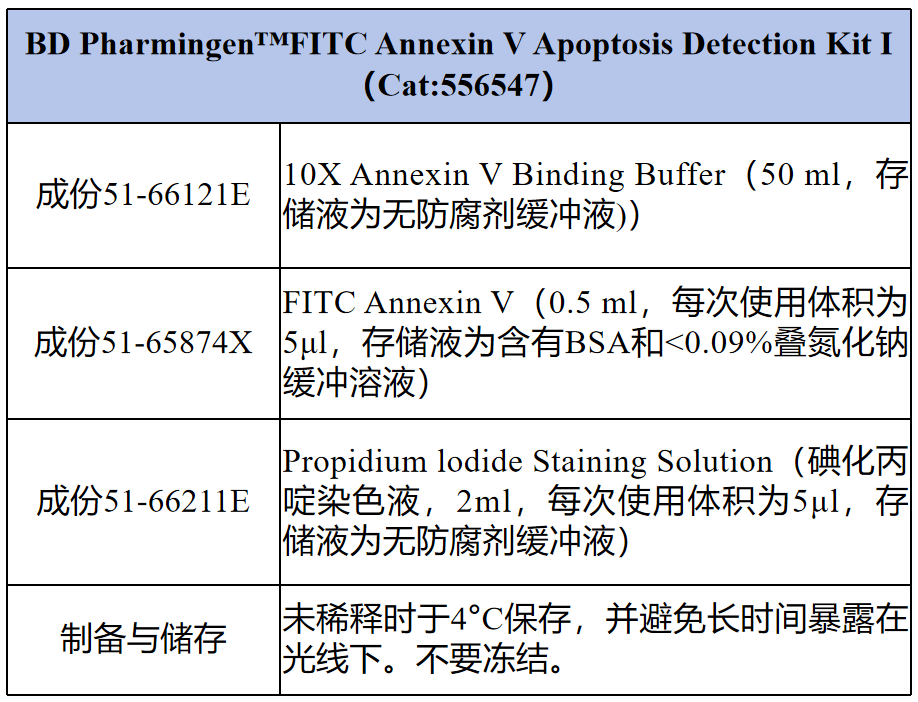
BD Pharmingen™ FITC Annexin V Apoptosis Detection Kit I (556547)
技术原理
凋亡是正常的生理过程,发生在胚胎发育过程以及组织稳态维持中。凋亡程序中发生包括细胞膜的不对称性和附着、细胞质和细胞核的浓缩,以及DNA的核小体间断裂。在凋亡细胞中,磷脂酰丝氨酸(PS)从细胞膜的内侧转移到外侧,从而使PS暴露在细胞外部环境中。Annexin V(膜联蛋白-V)是一种35-36 kDa的Ca2+依赖性磷脂结合蛋白,对PS具有很高的亲和力,并结合到暴露PS的细胞上。Annexin V可与包括FITC在内的荧光染料结合。这种形式保持其对PS的高亲和力,因此可作为对正在发生凋亡的细胞进行流式细胞仪分析的敏感探针。由于PS的外化发生在凋亡的早期阶段,FITC Annexin V染色可以比基于核变化(如DNA断裂)的检测方法更早地识别凋亡。
FITC Annexin V染色先于膜完整性丧失,后者伴随着由凋亡或坏死过程引起的细胞死亡的最后阶段。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和坏死细胞,PI能够透过细胞膜而将细胞核染红。因此将Annexin-V与PI结合使用,就可以检测出细胞群体中的早期凋亡细胞与晚期凋亡细胞。因此,通常将FITC Annexin V染色与丙碘啉(PI)或7-氨基放线菌素(7-AAD)等活性染料结合使用,以帮助研究人员识别早期凋亡细胞(PI阴性,FITC Annexin V阳性)。具有完整膜的活细胞排除PI,而死亡和受损细胞的膜对PI具有渗透性。例如,被认为是活细胞的细胞为FITC Annexin V和PI阴性;处于早期凋亡状态的细胞为FITC Annexin V阳性和PI阴性;处于晚期凋亡或已经死亡的细胞为FITC Annexin V和PI均为阳性。该检测不能区分经历凋亡死亡和经历坏死途径死亡的细胞,因为在任何情况下,死细胞都会同时染色为FITC Annexin V和PI。然而,当随时间测量凋亡时,细胞通常可以从FITC Annexin V和PI阴性(活着的,或没有可测量的凋亡)追踪到FITC Annexin V阳性和PI阴性(早期凋亡,膜完整性存在),最终到FITC Annexin V和PI阳性(晚期凋亡和死亡)。细胞在这三个阶段中的移动暗示着凋亡。相反,单次观察显示细胞同时为FITC Annexin V和PI阳性,本身并未提供有关细胞走向灭亡的过程信息。
FITC Annexin V染色方案
FITC Annexin V用于定量确细胞群中主动进行凋亡的细胞百分比。它依赖于细胞在凋亡的早期阶段失去膜对称性的特性。在凋亡细胞中,细胞膜磷脂酰丝氨酸(PS)从细胞膜的内层转移到外层,从而使PS暴露在外部环境中。Annexin V是一种依赖于钙离子的磷脂结合蛋白,对PS具有很高的亲和力,可用于识别暴露PS的凋亡细胞。丙碘啉(PI)是标准的流式细胞仪活力探针,用于区分活细胞和非活细胞。具有完整膜的活细胞排除PI,而死亡和受损细胞的膜对PI具有渗透性。对FITC Annexin V阳性且对PI阴性的细胞正在进行凋亡。对FITC Annexin V和PI均为阳性的细胞可能处于凋亡的最后阶段,正在进行坏死,或已经死亡。对FITC Annexin V和PI均为阴性的细胞是活着的且没有进行可测量的凋亡。
试剂
① FITC Annexin V (成份号51-65874X):每次测试使用5 µl。
② Propidium Iodide (PI) (成份号51-66211E):方便、即用型细胞核染料,每次测试使用5 µl。
③ 10X Annexin V Binding Buffer (成份号51-66121E):0.1 M Hepes/NaOH (pH 7.4);1.4 M NaCl;25 mM CaCl2.。1X工作液:将一份10X Annexin V Binding Buffer与9份无菌水混合。
染色
① 用预冷PBS清洗细胞2次,并用1X Binding Buffer重悬细胞至浓度1 x 10^6 cells/ml.
② 将100 µl细胞悬液(1 x 10^5 cells)转移至5 ml离心管。
③ 加入5 µl FITC Annexin V和5 µl PI
④ 轻柔混合,室温避光孵育15 min 。
⑤ 在1h内进行流式分析,期间向每管加入400 µl 1X Binding Buffer
流式细胞仪设置控制建议
(以下控制用于设置补偿和象限)
① 未染色细胞
② FITC Annexin V单染细胞
③ PI单染细胞
其他染色控制
1. 一个可以轻松诱导凋亡的细胞系应该用于使用FITC Annexin V和/或FITC Annexin V和PI进行阳性对照染色。重要的是要注意,在群体内,凋亡和坏死的基础水平变化很大。因此,即使在没有诱导凋亡的情况下,大多数细胞群体中也会包含少量阳性凋亡细胞(FITC Annexin V阳性,PI阴性或FITC Annexin V阳性,PI阳性)。
2. 未经处理的细胞群体用于定义凋亡和死亡细胞的基础水平。然后通过从未经处理细胞群体中的凋亡细胞百分比中减去经处理细胞群体中的凋亡细胞百分比来确定已被诱导凋亡的细胞百分比。由于细胞死亡是正在发生凋亡的细胞的最终结果,处于凋亡后期的细胞将具有受损的膜,并且会与PI以及FITC Annexin V一样染色阳性。因此,该分析无法区分已经经历凋亡细胞死亡的细胞和那些因坏死途径而死亡的细胞之间的区别,因为在任一情况下,死亡细胞都会与FITC Annexin V和PI一样染色阳性。
产品注意事项
① 亚硝酸钠在酸性条件下会产生高毒性的氮化氢。在丢弃前,请将亚硝酸盐化合物稀释在流动水中,以避免在管道中积聚潜在的爆炸性物质。
② FITC Annexin V是一种敏感的探针,用于识别凋亡细胞,结合到带有负电荷的磷脂表面(Kd约为5 x 10^-2),对磷脂酰丝氨酸(PS)的亲和力高于大多数其他磷脂。FITC Annexin V结合是依赖于钙离子的,需要特定的钙和盐浓度才能达到最佳染色效果,详细步骤请参考FITC Annexin V染色方案。研究人员应注意,对于贴壁细胞类型(如HeLa、NIH 3T3等),未经常规测试FITC Annexin V流式细胞仪分析,因为在细胞脱离或收获过程中可能会发生特定的膜损伤。然而,已经有关于在贴壁细胞类型上利用Annexin V进行流式细胞仪分析的方法报道(Casiola-Rosen等人和van Engelend等人)。
③ 请参考 www.bdbiosciences.com/pharmingen/protocols 获取技术方案。
案例1
用喜树碱诱导凋亡,以下操作作为示例说明如何在细胞系(Jurkat)上使用FITC Annexin V。
材料
准备喜树碱储备溶液(Sigma-Aldrich Cat. No. C-9911):1 mM DMSO中溶解。Jurkat T细胞(ATCC TIB-152)。
过程
将喜树碱(最终浓度为4-6 µM)加入1 x 10^6 Jurkat细胞中。在37°C下孵育细胞4-6小时。进行FITC Annexin V染色方案,以测量凋亡情况。
实验结果
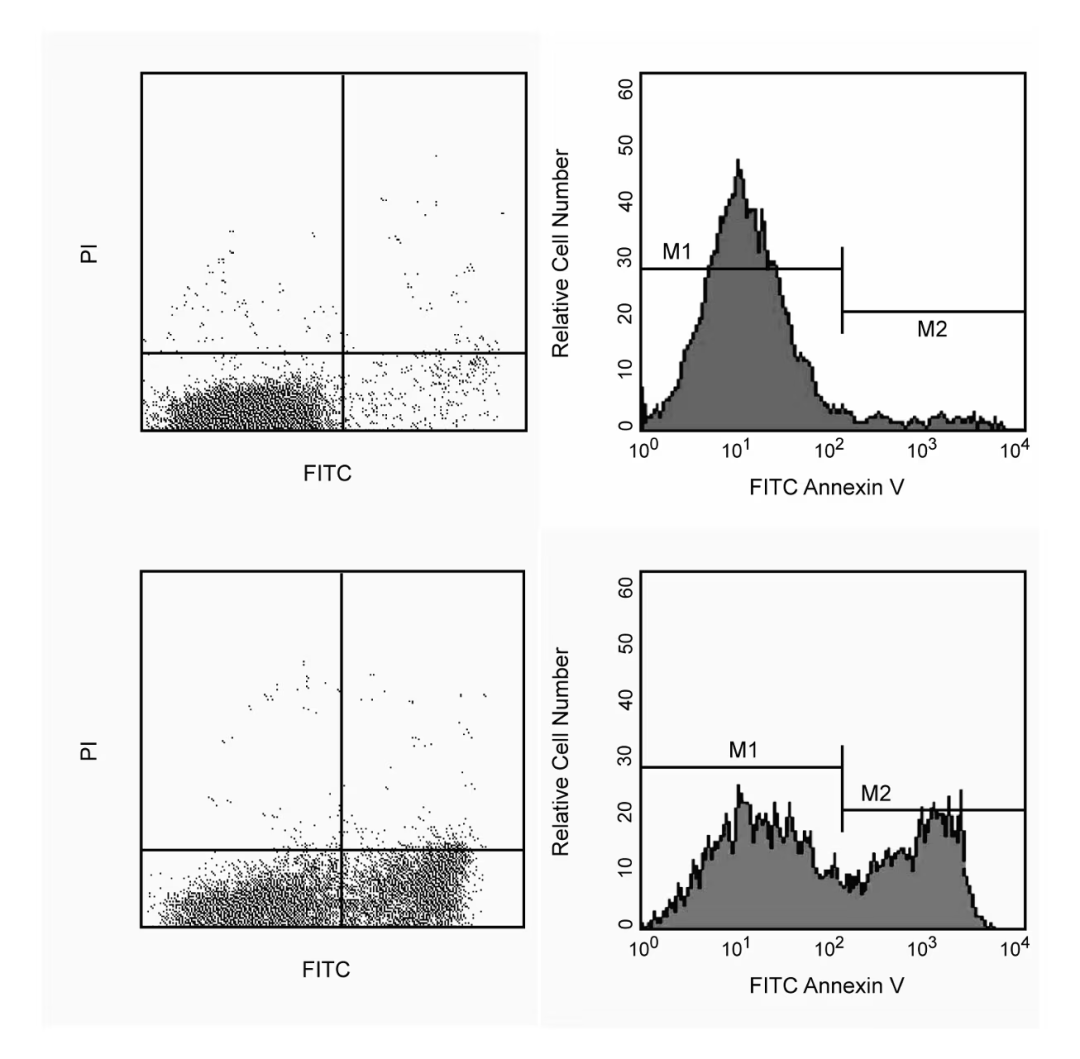
对FITC Annexin V染色的流式细胞仪分析。Jurkat细胞(人T细胞白血病;ATCC TIB-152)未经处理(顶部)或经过12µM喜树碱处理4小时(底部)。细胞在含有丙碘啉(PI)的缓冲液中与FITC Annexin V共孵育,并通过流式细胞仪分析。未经处理的细胞主要是FITC Annexin V和PI阴性,表明它们是活着的且没有进行凋亡。经过4小时处理后(底部),主要有两个细胞群:不进行凋亡的细胞(FITC Annexin V和PI阴性)和正在进行凋亡的细胞(FITC Annexin V阳性和PI阴性)。观察到少量的细胞为FITC Annexin V和PI阳性,表明它们处于晚期凋亡或已经死亡。
【参考文献】
[1] Andree HA, Reutelingsperger CP, Hauptmann R, Hemker HC, Hermens WT, Willems GM. Binding of vascular anticoagulant alpha (VAC alpha) to planar phospholipid bilayers. J Biol Chem. 1990; 265(9):4923-4928. (Biology)
[2] Casciola-Rosen L, Rosen A, Petri M, Schlissel M. Surface blebs on apoptotic cells are sites of enhanced procoagulant activity: implications for coagulation events and antigenic spread in systemic lupus erythematosus. Proc Natl Acad Sci U S A. 1996; 93(4):1624-1629. (Biology)
[3] Homburg CH, de Haas M, von dem Borne AE, Verhoeven AJ, Reutelingsperger CP, Roos D. Human neutrophils lose their surface Fc gamma RIII and acquire Annexin V binding sites during apoptosis in vitro. Blood. 1995; 85(2):532-540. (Biology)
[4] Koopman G, Reutelingsperger CP, Kuijten GA, Keehnen RM, Pals ST, van Oers MH. Annexin V for flow cytometric detection of phosphatidylserine expression on B cells undergoing apoptosis. Blood. 1994; 84(5):1415-1420. (Biology)
[5] Martin SJ, Reutelingsperger CP, McGahon AJ, et al. Early redistribution of plasma membrane phosphatidylserine is a general feature of apoptosis regardless of the initiating stimulus: inhibition by overexpression of Bcl-2 and Abl. J Exp Med. 1995; 182(5):1545-1556. (Biology)
[6] O'Brien MC, Bolton WE. Comparison of cell viability probes compatible with fixation and permeabilization for combined surface and intracellular staining in flow cytometry. Cytometry. 1995; 19(3):243-255. (Biology)
[7] Raynal P, Pollard HB. Annexins: the problem of assessing the biological role for a gene family of multifunctional calcium- and phospholipid-binding proteins. Biochim Biophys Acta. 1994; 1197(1):63-93. (Biology)
[8] Schmid I, Krall WJ, Uittenbogaart CH, Braun J, Giorgi JV. Dead cell discrimination with 7-amino-actinomycin D in combination with dual color immunofluorescence in single laser flow cytometry. Cytometry. 1992; 13(2):204-208. (Biology)
[9] van Engeland M, Ramaekers FC, Schutte B, Reutelingsperger CP. A novel assay to measure loss of plasma membrane asymmetry during apoptosis of adherent cells in culture. Cytometry. 1996; 24(2):131-139. (Biology)
[10] Vermes I, Haanen C, Steffens-Nakken H, Reutelingsperger C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. J Immunol Methods. 1995; 184(1):39-51. (Biology)
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味










